-
이탈리아 외과용 봉합사 시장 동향
- 상품DB
- 이탈리아
- 밀라노무역관 유지윤
- 2025-12-15
- 출처 : KOTRA
-
정밀 수술 확대에 따른 고기능 봉합재 수요 증가
유럽연합의 의료기기(MDR) 인증 강화로 인증 선제 대응 필요
상품명 및 HS Code
HS 코드
상품명
300610
멸균 외과용 봉합재 및 조직접착제류
- 멸균 봉합사, 조직접착제, 지혈제 등 수술·의료용 생체소재로 사용되는 핵심 소모품
시장 동향
HS코드 300610(외과용 봉합사)은 이탈리아에서 의료기기, 생명과학, 바이오소재 산업에서 광범위하게 사용되는 필수 멸균 소모품으로, 인체 조직 봉합, 지혈, 조직 복원 등 다양한 외과 시술에 필수적으로 사용된다. 특히 고령화 심화, 만성질환 증가, 최소 침습 및 로봇수술 확산 등으로 정밀수술 수요가 확대되면서 시장이 꾸준히 성장하고 있다. 또한, 의료 현장의 자동화·디지털화 추세에 따라 고기능 복합 소재 및 자동 봉합기 전용 제품의 수요가 확대되고 있다.
시장조사기관 Grand View Research에 따르면, 이탈리아 외과용 봉합사 시장은 2024년 약 9340만 달러 규모로 나타났으며, 2030년에는 약 1억2370만 달러 수준까지 확대될 전망이다. 2025년부터 2030년까지 연평균 성장률(CAGR)은 약 4.8% 수준으로 예상된다.
<2018~2030년 이탈리아의 의료용 봉합사 시장 동향>
(단위: US$ 백만)
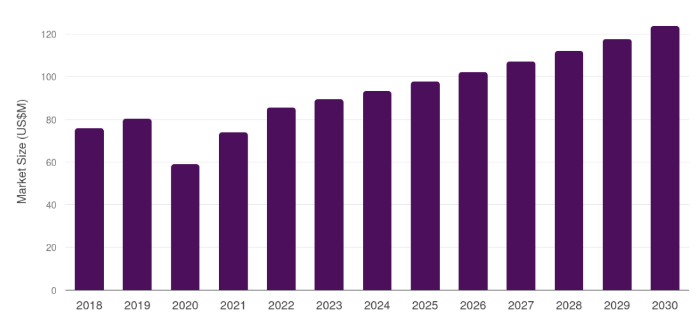
[자료: Grand View Research]
이탈리아 내에서 HS코드 300610 품목의 주요 수요처는 외과와 정형외과 분야로 파악된다. 외과 및 일반수술 분야에서는 공공병원의 수술 건수 증가와 함께 멸균 흡수성 봉합사 수요가 가장 크며, 정형외과에서는 조직 복원 및 임플란트 수술 증가로 고강도 합성 봉합사 사용이 확대되고 있다. 치과 및 성형외과에서도 미세수술용 비흡수성 봉합사에 대한 수요가 꾸준히 유지되고 있으며, 최근에는 수의학 및 생명과학 연구 기관에서도 실험용 봉합재 사용이 늘고 있다. 봉합사는 멸균품의 유효기간(통상 3~5년)과 병원별 위생 규제에 따라 정기 교체가 필수적인 대표 항목으로 꼽힌다. 또한, 로봇수술과 최소침습수술(MIS)의 확산으로 특수 규격 및 자동 봉합기 전용 제품 수요도 빠르게 증가하고 있다.
최근 외과용 봉합사 시장에서는 천연 봉합사(catgut)보다 합성 흡수성 소재(PGA, PLA, PGLA 등)가 주류로 자리 잡고 있다. 이러한 합성소재는 생체적합성이 높고 감염 위험이 낮으며, 체내 흡수 속도를 조절할 수 있어 의료진과 환자 모두에게 선호도가 높다. 더불어 조직 재생을 유도하는 바이오 활성 봉합사, 항균 코팅 봉합사, 수술 로봇 전용 미세 봉합제 등 고부가가치 제품의 비중이 지속적으로 확대되고 있다.
이탈리아 정부의 국가 회복 탄력 계획(PNRR)과 유럽연합의 의료기기 규제(MDR, Regulation(EU) 2017/745) 시행은 병원 현대화 및 의료용 소모품 품질관리 강화에 직접적인 영향을 미치고 있다. 정부는 병원 수술실의 자동화와 디지털화를 장려하며, 봉합사와 같은 고품질 멸균 소모품의 공급 확대를 유도하고 있다.
주재국 수입 동향 및 대한 수입 규모
이탈리아의 외과용 봉합사(HS코드 300610)는 의료서비스 수요 확대와 수술 건수 증가에 힘입어 꾸준한 성장세를 보인다. 특히 고령화 심화, 만성질환 확대, 병원 현대화 정책 추진 등 구조적 요인이 복합적으로 작용하면서 수입 시장 역시 안정적인 흐름을 유지하고 있다.
2024년 기준 이탈리아의 외과용 봉합사 수입액은 약 1억8064만 달러로, 전년 대비 1.7% 증가했다. 2023년의 10% 성장보다 상승폭은 크게 둔화했지만, 여전히 시장의 수요 기반이 견고하게 유지되고 있음을 보여준다.
국가별로 수입 동향을 살펴보면 2024년 기준 벨기에가 약 54%의 시장 점유율을 차지했으며, 오스트리아와 네덜란드, 스페인이 그 뒤를 이었다. 이는 인근 유럽국으로부터의 수입이 주를 이루고 있음을 보여준다. 이 외 주요 수입국 중 미국(+40.5%), 그리스(+48.7%), 헝가리(+39.5%)로부터의 수입 증가세가 보인다. 이는 공급망 다변화에 따른 결과이며, 전반적으로 서유럽 중심의 안정된 구조를 유지하되 동유럽·비EU 지역 비중이 점차 확대되는 추세인 것으로 보인다.
<2022~2024년 이탈리아의 외과용 봉합사(HS Code 300610) 수입 동향>
(단위: US$ 천, %)
순위
국가
수입액
증감률
('24/'23)
2022
2023
2024
1
벨기에
74,804
93,382
96,797
3.7
2
오스트리아
14,984
13,709
17,689
29.0
3
네덜란드
18,908
22,815
17,130
-24.9
4
스페인
11,527
12,275
13,850
12.8
5
독일
13,474
9,042
9,085
0.5
6
프랑스
4,604
5,410
5,244
-3.1
7
아일랜드
4,604
5,876
5,189
-11.7
8
미국
2,081
2,651
3,725
40.5
9
그리스
2,263
1,636
2,431
48.7
10
헝가리
878
787
1,099
39.5
16
대한민국
644
564
624
10.7
* 주: 순위는 2024년 기준
[자료: Global Trade Atlas, 2025.11.27.]
대한수입 규모 및 동향
한국산 의료용 봉합사(HS코드 300610)는 이탈리아 시장에서 꾸준히 수입되고 있으며, 최근 뚜렷한 성장세를 보인다. 이탈리아 내 의료기기 소비 확대, 수술용 소모품 교체 주기 단축, 병원 현대화 및 공급망 다변화 정책 등이 맞물리면서 한국산 제품에 대한 수요가 점차 확대되는 추세다.
이탈리아의 대(對)한국 의료용 봉합사 수입액은 2021년 64만3934달러에서 2022년 64만4305달러로 거의 변동이 없었으나, 2023년에는 56만3703달러로 12.5% 감소했다. 그러나 2024년 들어 수입액이 62만4323달러로 10.7% 반등하며 회복세로 전환됐고, 2025년 1~9월 누적 수입액은 836,762달러로 전년 동기 대비 68.9% 급증했다.
시장 점유율 또한 상승세를 보인다. 한국산 봉합사의 이탈리아 시장 점유율은 2021년에서 2024년까지 0.3~0.4%의 점유율을 유지했으나, 2025년 0.8%까지 상승하며 점유율이 두 배 이상 확대됐다. 수입국 순위 역시 2025년 1월~9월 기준 11위로 상승했다.
<2021년~2025년 9월 이탈리아의 대한국 의료용 봉합사 수입 동향>
(단위: US$, %)
2021년
2022년
2023년
2024년
2025년 1~9월
수입액
643,934
644,305
563,703
624,323
836,762
전년대비 증감률
51.3
0.1
-12.5
10.7
68.9
시장 점유율
0.4
0.4
0.3
0.4
0.8
수입국 순위
13
17
17
16
11
[자료: Global Trade Atlas, 2025.11.27.]
경쟁 동향
이탈리아의 의료용 봉합사(HS코드 300610) 시장은 제품의 소재, 흡수성 여부, 멸균 방식, 적용 분야 등에 따라 고기능 의료용 제품 시장과 범용 봉합사 시장으로 구분된다.
고기능 의료용 봉합사는 주로 외과, 정형외과, 심혈관, 성형외과, 치과 등 고난도 수술에 사용되며, 생체적합성과 봉합 강도, 흡수성 조절 기술이 핵심 경쟁 요소로 꼽힌다. 이 부문에서는 Ethicon(Johnson & Johnson 계열), Medtronic, B. Braun, Peters Surgical 등 글로벌 제조사와 이탈리아 제조사인 Assut Europe가 시장을 주도하고 있다. 이들 기업은 합성 흡수성 소재(PGA, PLA, PGLA 등)와 천연 단백질계 소재(실크, 콜라겐 등)를 기반으로 다양한 제품군을 공급하며, CE 및 MDR 인증을 바탕으로 이탈리아 병원 입찰 시장에서 높은 신뢰도를 확보하고 있다.
범용 봉합사 시장은 비교적 단가가 낮은 비흡수성 합성소재(나일론, 폴리프로필렌, 폴리에스터 등) 중심으로 구성돼 있으며, 치과, 수의학, 일반 외상치료, 실습용 등 폭넓은 수요처를 갖는다. 이 시장에서는 국내외 중소 제조사와 OEM 생산업체들의 경쟁이 활발하며, 한국, 인도, 중국, 튀르키예 등지에서 생산된 봉합사가 현지 유통망을 통해 공급되고 있다. 최근에는 품질과 멸균 안전성을 개선한 아시아산 제품이 중소병원과 개인 클리닉에서 점차 채택되는 추세다.
유통 구조
이탈리아의 의료기기는 전통적으로 수입·유통사(Importer/Distributor) – 의료기관(End User)로 이어지는 유통 체계가 주를 이룬다. 유통업체가 수입까지 담당하는 구조로, 수입·유통사는 유럽 내 제조사 또는 해외 공급업체로부터 CE 및 MDR 인증 제품을 들여와 현지 의료기기 등록 절차를 대행하고, 병원, 클리닉, 약국, 의료기기상 등으로 납품을 담당한다. 전국 또는 광역권 단위 공급망을 보유한 주요 유통사로는 GIMA, Medline Italy, Hospitex, Biocom, Adria Med 등이 있다.
최근에는 디지털 조달 시스템의 확산과 함께 공공의료기관은 지역별 보건조달시스템을 통해 입찰을 진행하며, 이를 통해 가격 투명성과 품질 인증 여부를 엄격히 관리하고 있다. 또한 병원들은 봉합사와 수술기구를 패키지로 공급받는 계약 형태를 선호하고 있으며, 이 과정에서 제조사와 유통사가 컨소시엄 형태로 입찰에 참여하는 경우가 늘고 있다.
이탈리아 의료기관들은 멸균 소모품의 유효기간(보통 3~5년)과 감염관리 기준에 따라 정기적으로 봉합사를 재입고하고 있다. 이러한 정기 재공급(replacement demand) 및 재입찰(renewal tender) 수요가 시장의 안정적인 수입·유통 기반을 형성하며, 제조사와 유통사 간의 장기 파트너십 구축으로 이어지고 있다. 이에 따라 주요 공급업체들은 단순 납품을 넘어 재고 관리, 제품 교육, 사용 후 품질 모니터링 등 부가 서비스를 함께 제공하며 병원과의 거래 신뢰도를 높이는 전략을 펼치고 있다.
관세율
한-EU FTA 체결로 이탈리아 내 외과용 봉합사의 수입 관세율은 0%의 적용을 받는다.
* (EU 관세율 조회) http://ec.europa.eu/taxation_customs/dds2/taric/taric_consultation.jsp
규제 및 인증
의료용 봉합사는 인체에 직접 사용되는 멸균 의료기기로 분류되기 때문에, 유럽연합 의료기기 규정(MDR, Regulation (EU) 2017/745)의 적용을 받는다. 산업용 부품과 달리 CE 인증 취득이 의무이며, 유럽 시장에 유통되는 모든 의료용 봉합사는 CE 마크 부착 및 인증기관(Notified Body)의 심사를 통과해야 한다.
CE 인증 절차는 의료기기의 위험도에 따른 분류 등급(Class)에 따라 달라진다. 외과용 봉합사는 인체 내 삽입돼 일정 기간 체내에 남는 특성상 흡수성 외과용 봉합사는 Class III(고위험군 의료기기), 비흡수성 봉합사는 사용 목적에 따라 Class lla/llb 등으로 분류된다. 따라서 제조업체는 유럽 내 지정 인증기관의 정식 심사를 거쳐야 하며, 품질관리시스템(QMS) 인증(예: ISO 13485)과 임상 평가 보고서(Clinical Evaluation Report, CER) 제출이 필수다. 제품 설계부터 생산, 멸균, 포장, 추적 관리까지 전 과정이 MDR 부속서(Annex IX~XI)에 따라 검증돼야 한다.
또한, 봉합사는 멸균 제품이므로, 멸균 공정 검증(ISO 11135, EO gas sterilization / ISO 11137, radiation sterilization 등)과 생체적합성 평가(ISO 10993 시리즈)도 요구된다. 봉합 재질에 따라 인체 반응, 흡수 속도, 잔류 물질 등을 평가해야 하며, 흡수성 소재의 경우 체내 분해 시험 결과가 임상시험 또는 동등성 평가로 입증돼야 한다.
이 외에도 유럽연합은 의료기기 전반에 대해 UDI(Unique Device Identification, 고유 식별코드) 부착을 의무화하고 있으며, 모든 CE 인증 제품은 EUDAMED(유럽 의료기기 데이터베이스)에 등록돼야 한다. 수출기업이 직접 등록하기 위해서는 유럽 내 대리인(Authorized Representative, EC REP)을 지정해야 하며, 제품 라벨에는 CE 마크, 인증기관 번호, 제조사명, 수입자명, 유효기간, 멸균 방식 등이 명시돼야 한다.
또한, 이탈리아 시장에 제품이 출시되기 위해서는 CE 인증과 별개로 이탈리아 보건부(Italian Ministry of Health)의 의료기기 국가 데이터베이스(DB/RDM)에 해당 기기와 경제주체(제조사, 유럽 내 대리인, 이탈리아 수입자 등)를 등록해야 한다. EUDAMED가 완전히 가동되기 전까지 이탈리아는 모든 등급의 의료기기에 대해 자국 국가 데이터베이스 등록을 요구하고 있다. 이를 위해 이탈리아 내 수입자 또는 지정 대리인이 보건부 시스템 접근 권한(스마트카드 등)을 보유하고, CND(Classificazione Nazionale Dispositivi medici) 코드에 따라 제품을 분류·신고해야 한다. 비EU 제조사의 경우 유럽 내 대리인과 이탈리아 현지 수입자를 통해 보건부 등록을 진행한 후에야 이탈리아 시장에 정식으로 공급할 수 있다.
시사점
이탈리아 외과용 봉합사 시장은 고령화 및 수술 증가, 로봇·최소 침습 수술 확산 등으로 안정적인 성장세를 보인다. 병원 현대화와 기술 발전에 따라 합성 흡수성 소재 중심의 고기능 및 고부가가치 제품 수요가 확대되고 있으며, 멸균 유효기간에 따른 정기 교체 수요도 존재해 시장 기반은 견조한 편이다. 기존에는 글로벌 기업 중심의 시장 구조였으나, 특수 목적형 및 첨단 봉합재 분야에서는 대체 공급처에 대한 수요가 늘어나면서 신규 진입 가능성이 확대되는 추세다.
유럽연합 의료기기 규제(MDR) 강화에 따라 고위험군 제품 기준 충족이 시장 진입의 핵심 요소가 될 전망이며, 공급망 다변화가 진행되면서 한국산 봉합재에 대한 관심도 증가하고 있다. 신규 진출 기업은 CE 및 MDR 인증 대응을 기반으로 고부가가치 제품 중심의 전략을 추진하고, 현지 유통 네트워크 활용 및 병원 대상 기술지원·품질관리 연계 방식으로 접근할 경우 시장 확대 가능성이 높을 것으로 전망된다.
자료: Grand View Research, GM Insights, MarketsandMarkets, European Commission, ISTAT, Global Trade Atlas, KOTRA 밀라노무역관 종합
<저작권자 : ⓒ KOTRA & KOTRA 해외시장뉴스>

KOTRA의 저작물인 (이탈리아 외과용 봉합사 시장 동향)의 경우 ‘공공누리 제4 유형: 출처표시+상업적 이용금지+변경금지’ 조건에 따라 이용할 수 있습니다. 다만, 사진, 이미지의 경우 제3자에게 저작권이 있으므로 사용할 수 없습니다.
-
1
홍콩 소비재 전자전시회로 살펴보는 2026 기술 트렌드
홍콩 2025-12-15
-
2
프라이즈 아케이드의 귀환, 오프라인 게임이 다시 뜨는 이유
미국 2025-12-15
-
3
일본 수산·양식업, DX로 인력 부족 돌파구 찾는다
일본 2025-12-15
-
4
일본 정수기 시장 동향
일본 2025-12-15
-
5
1인 가구 증가와 함께 커지는 일본 셀프 돌봄 시장
일본 2025-12-15
-
6
2025년 사우디아라비아 의료기기 산업 정보
사우디아라비아 2025-12-12
-
1
2025년 이탈리아 조선산업 정보
이탈리아 2025-09-02
-
2
2025년 이탈리아 자동차 부품 산업 정보
이탈리아 2025-05-23
-
3
2024 이탈리아 체외진단기기 산업 정보
이탈리아 2024-10-04
-
4
2024 이탈리아 우주 산업 정보
이탈리아 2024-07-14
-
5
2021년 이탈리아 제약산업 정보
이탈리아 2021-09-08
-
6
2021년 이탈리아 섬유·패션산업 정보
이탈리아 2021-09-07
- 이전글
- 다음글













