-
[유망] 일본 원료 의약품 시장동향
- 상품DB
- 일본
- 오사카무역관 조은진
- 2017-12-27
- 출처 : KOTRA
-
- 연간 4240억 엔 규모, 일본 정부의 복제약 촉진 조치 등으로 성장세 -
- 일본 대형 제약회사, 의약품 원료 외주 강화 추세 –
- 한국 의약품, 품질 및 가격경쟁력 확보로 수출 증가세 -
□ 상품명 및 HS Code
ㅇ 상품명: 기타 원료 의약품(HS Code 2933.39 등)
□ 선정 사유
ㅇ 원료 의약품시장은 2016년도부터 2021년도까지 연 평균 2.6%씩 확대가 기대됨.
ㅇ 또한 대형 제약사를 중심으로 의약품 원료 제조 외주가 확대되는 추세임.
- 위탁 제조 비율은 2021년에는 75%에 달할 전망
- 특히 의료비 억제를 위한 정부의 제네릭 시프트(ジェネリックシフト) 정책으로, 보급이 급속히 확대되는 복제약은 가격 경쟁력과 품질을 보유한 수입 원료 비중이 큼.
□ 시장규모 및 동향
ㅇ 2016년도(회계연도 기준. 즉 해당연도 4월부터 익년 3월까지 기간)의 일본 의약품 생산액(수입품 제외)은 약 6조6500억 엔이며, 그 중 원료 의약품 시장규모는 4240억 엔으로 파악됨.
- 현재 제약회사의 원료 자체 생산율은 약 36%에 불과하며, 원료 생산의 약 64%가 위탁 생산되고 있음.
ㅇ 원료 의약품 수요가 증가하는 이유는 약가 개정에 따른 약가 하락, 제약회사 주력제품의 특허 실효(失効), 일본 정부의 복제약 촉진, 화학기업 등 이업종 기업 및 해외기업의 시장진입 등을 들을 수가 있음.
- 특히 일본 정부는 2020년 9월 말까지 복제약 수량 점유율 80% 달성(2017년 5월 발표)을 목표로 함. 이에 따라 처방 기준의 변경, 조제약국에의 인센티브 제공 등을 통해 복제약 보급 확대를 착실하게 추진 중
- 가격 경쟁이 치열해지는 상황에서 복제약 제조기업을 중심으로 의약품 원료 수입 수요 확대가 기대됨.
원료 의약품 및 중간체 시장규모 추이
회계연도
2014
2015
2016*
2017*
2018*
2019*
2020*
2021*
금액(억 엔)
3,860
4,080
4,240
4,380
4,500
4,620
4,720
4,820
증감률(%)
+5.5
+5.7
+3.9
+3.3
+2.7
+2.7
+2.2
+2.1
주*: 2016년도는 전망치, 2017년 이후는 예측치임
자료원: 야노경제연구소
□ 한국의 원료 의약품 수출 추이
ㅇ 한국 원료 의약품 수출은 꾸준히 증가하고 있음.
- 2011년 9억 달러에서 2016년 14억 달러로, 해당 기간 연평균 9.1%씩 성장
한국 원료 의약품 수출 추이
구분
2011
2012
2013
2014
2015
2016
수출액(천 달러)
906,832
1,055,464
1,099,284
1,169,558
1,281,430
1,409,072
자료원: 한국제약협회
ㅇ 일본은 우리나라의 최대 원료 의약품 수출 국가
- 2016년 대일 수출은 전년 대비 25.9% 증가한 30만 달러를 기록
한국의 최근 3년간 대일 원료 의약품 수출 추이
(단위: 천 달러)
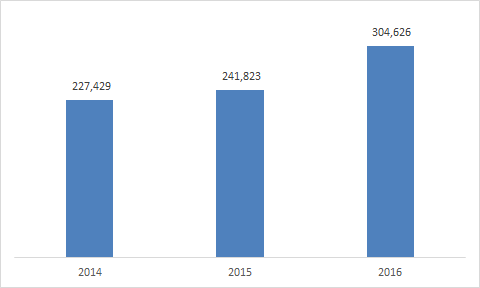
자료원: 한국제약협회
□ 경쟁기업 동향
ㅇ 일본의 주요 원료 의약품 기업은 아래 표와 같음.
일본의 주요 원료 의약품 기업 동향
기업명
동향
Sumitomo Chemicals
- 생산공정 개선 및 가격경쟁력 향상을 통해 복제약 원료사업 확대 추진
API Corporation
- 메이저 제약기업에 신약 원료를 공급한 실적이 많음
- 향후 복제약 원료 납품에도 주력, 매출액의 50% 수준까지 늘릴 계획
- 현재 복제약 원료는 해외기업에서 조달하고 있음. 자사 개발품과 함께 30성분 정도를 취급할 계획
Fujimoto Chemicals
- 항암제 등에 사용되는 고효능 활성 원료 의약품(高薬理活性医薬原体, HPAPI; High Potency Pharmaceutical Ingredients)에 대한 수요가 높아지나, 분쇄까지 할 수 있는 기업은 일본에 많지 않아 해외기업에 주로 위탁하는 상황
- 이에 일본 기업의 분쇄 수요를 국내로 돌리기 위해 고효능 활성 원료 의약품 제조설비뿐만 아니라 분쇄기까지 도입하는 등 설비 투자 확대
Ube Industries
- 해외기업과의 연계를 포함해 가격경쟁력 강화를 위해 공급선 재구축을 추진 중
- 신약 원료를 중심으로 사업 확대를 추진 중
- 고효능 활성 원료 의약품 설비를 구축해 2016년부터 가동하고 있음
Hamari Chemicals
- 펩티드 합성에 강점을 보유한 기업으로, 독자 개발한 합성기술을 응용해 비천연형 아미노산 제조, 펩티드 원약 공급체계 구축을 통한 시장 확대를 위해 노력 중
Nissan Chemical
Industries
- 2016년 3월 복제약 원료시장에 진출함.
- 고활성화·고부가가치 후발의약품을 중심으로 수요확대를 추진하고 있음
Sekisui Medical
- 신약을 중심으로 원료 공급
- PMDA(의약품의료기기종합기구)의 GMP(Good Manufacturing Practice) 적합성 조사의 대상이 되는 원료 공급에 주력하고 있음. GMP 적합성 조사는 일반 의약품의 원료 의약품은 조사를 받을 필요가 없고, 주로 약국 제조 판매용 원료 의약품 등이 대상이 됨.
자료원: 야노경제연구소
□ 관세율, 인증 절차 및 제도
ㅇ WTO 협정 관세율은 0~6.5%이며, 통관 시(CIF+관세)의 금액에 소비세 8%가 부가됨.
원료 의약품별 수입 관세율
구분
HS Code
일본 관세율
비타민(원료)
2936.21~90
- 0%
항생물질(원료)
2930.20, 2941.10~90
- 2930.20은 4.4%, 2941은 0%
향정(원료)
2921.46,2922.31/39/44, 2924.11/24, 2933.49, 2934.91, 2939류
- 2921.46, 2924.24, 2934.91은 3.1%
- 2922.31/39/44는 3.9%
- 2924.11, 2939는 0%
- 2933.49는 3.3~3.1%혈·혈청
3001.90, 3002류
- 3001.90은 0%
- 3002는 0~3.1%호르몬제(원료)
2922.41, 2937류
- 2922.41는 3.9%
- 2937은 0%기타 원료 의약품
1211.90, 1302.12, 2810.00, 2811.29, 2833.29, 2835.10, 2837.19, 2841.50/90, 2842.90, 2852.10 2901.29, 2903.77/82, 2903.89/91, 2905.43/45/49/59, 2906.11/13/19, 2907.19, 2909.49/50/60, 2910.10/90, 2912류, 2914.69, 2915류, 2916류, 2917.11/12, 2918류, 2921.11/19, 2922류, 2923.10/90, 2924류, 2926.90, 2928.00, 2930.40/90, 2931.90, 2932류, 2933류, 2934.99, 2935.00, 2938류, 2940.00, 3001류, 3006류, 3301.90, 3302.90, 3503.00, 3507.10/90, 3821.00, 3822.00, 3823.11, 3905.99, 3912.31/39, 3912.90, 9602.00
- 0~6.5%
주: 한국산의 경우에는 협정관세율이 적용됨
자료원: 일본 관세협회 '실행관세율표2017'
ㅇ 원료 의약품 정보 보호를 위한 제도
- 모든 신규 완제 의약품은 PDMA 허가를 받아야 하는데, 허가를 위한 심사 과정에서 원료 의약품 공급사가 원료 의약품 정보 보호(지적재산 보호)를 희망할 경우 원약등등록원부(原薬等登録原簿, 이하 MF라 함)제도를 이용할 수가 있음.
- 원료 의약품 공급회사(일본 기업 혹은 해외기업)가 제품만 공급하기를 희망하고, 제조 방법・품질관리 등 노하우는 거래처인 일본 제조사(완제 의약품 승인 신청자)에 공개하기 싫을 경우 PMDA에 제조방법・제조관리・품질관리 등 심사에 필요한 정보를 사전에 등록하면, 보호하고 싶은 정보는 공개하지 않고 PMDA 등록 번호만 가지고도 원료 의약품 포함 완제품 심사가 가능함.
- 해당 제도는 임의 등록제이며, 해외 기업의 경우 등록을 희망할 경우 일본국내에 주소가 등록된 사람(원약등관리인이라 함)을 통해 PMDA에 신청해야 함.
□ 활용 가능한 마케팅 방안
ㅇ 현지 전시회 정보
전시회명
제12회 의약품원료 국제전(第12回 医薬品原料 国際展, In-PHARMA JAPAN)
전시 품목
의약품원료, 화장품원료, 중간체, 첨가재, 기능성소재, 천연추출물, 분속기, 그 외 서비스
개최 국가 및 도시
일본, 도쿄
개최 주기
연간 1회 개최 기간
2018년 6월 27(수)~29일(금)
2017년
개최규모
- 참가업체 수: 93개사(In-PHARMA JAPAN)
- 참관객: 약 56,000명(의약품·화장품·세제 연구제조기술전, 바이오의약품EXPO 등 동시 개최 전시회 포함)
웹사이트
□ 국내기업 시사점
ㅇ 일본 원료 의약품시장은 정부의 복제약 보급 확대 정책 및 약가 인하 등으로 2020년까지는 지속적 확대가 기대됨.
- 그러나 이미 일본 진출에 성공한 해외기업도 많고 일본 메이저 제약기업의 해외 진출도 증가하고 있어, 수요가 감소하기 전에 바이어와의 관계를 구축하는 것이 중요함.
- 한편 최근 해외에서의 공급이 늘어나면서 대기업이 잘 하지 못하는 신속한 대응, 소량 대응 등의 측면에서 중소 및 중견 제약기업의 존재 가치가 오르고 있으므로, 이런 측면을 바이어에게 어필하는 것도 방법임.
ㅇ 일본 제약회사의 외부 위탁 생산도 증가하고 있으나, 품질관리 체계에 대한 요구 수준이 높아지고 있고 납기 단축이 가능한 기업을 선호하므로 원료 의약품 등의 위탁 생산으로 일본 시장에 진출하려는 경우 이에 대한 대비가 필요함.
- 일본 제약회사는 수익 확대를 위해서 생산량이 적은 제품, 신규 설비가 필요한 제품, 수요 증감이 큰 제품, 특수한 기술이 필요한 제품 등 자사에서 제조하는 이점이 적은 제품 혹은 신규 투자를 포함해 투자 확대의 부담이 큰 제품 생산을 외부에 위탁하고 있음.
- 일본 제약회사의 납품기업 선정기준으로는 ① 일본 품질관리 기준에의 적합성, ② 안정된 공급량, ③ 가격경쟁력, ④ 납기 준수, ⑤ 경영의 안정성, 상사를 통할 겨우 상사의 자질(정보 유출 등 관련), ⑥ 일본 기업과 거래 실적, ⑦ 커뮤니케이션 능력(정보의 정확성, 정보의 신속성)을 들을 수가 있음.
- 최근 품질 면에서 GMP기준을 만족시키는 등 바이어의 품질관리 체계에 대한 요구가 높아지는데, FDA 수준까지 원하는 경우도 있으니 품질관리 체계를 철저히 해야 함.
자료원: 야노 경제연구소, 한국제약협회, 일본 세관 등 KOTRA 오사카 무역관 자료 종합
<저작권자 : ⓒ KOTRA & KOTRA 해외시장뉴스>

KOTRA의 저작물인 ([유망] 일본 원료 의약품 시장동향)의 경우 ‘공공누리 제4 유형: 출처표시+상업적 이용금지+변경금지’ 조건에 따라 이용할 수 있습니다. 다만, 사진, 이미지의 경우 제3자에게 저작권이 있으므로 사용할 수 없습니다.
-
1
일본 의약품 시장 동향
일본 2022-10-21
-
2
일본 의약품 CDMO 시장 현황과 전망
일본 2021-11-29
-
3
코로나19가 불러온 뉴질랜드 뷰티 퍼스널케어 시장의 변화는?
뉴질랜드 2020-08-10
-
4
2021년 일본 의료기기 산업 정보
일본 2022-01-20
-
5
미국 원료의약품 시장동향
미국 2021-12-27
-
6
벨기에 제약산업 동향
벨기에 2023-11-27
-
1
2021년 일본 석유산업 정보
일본 2022-01-20
-
2
2021년 일본 의료기기 산업 정보
일본 2022-01-20
-
3
2021년 일본의 산업 개관
일본 2021-12-29
-
4
2021 일본의 정보 보안 산업
일본 2021-12-29
-
5
2021 일본의 수산업
일본 2021-12-29
-
6
2021 일본의 자동차 산업
일본 2021-12-29













