-
일본 치과용 기기 시장 동향
- 상품DB
- 일본
- 후쿠오카무역관 황신혜
- 2025-09-16
- 출처 : KOTRA
-
구조적 수요 확대가 지속되는 일본 치과용 기기 시장
다층적 유통망과 지역 밀착형 진료소 중심 구조
상품명 및 HS 코드
HS Code
상품명
902213
기타(치과용으로 한정한다)
시장동향
<일본 치과용 기기 시장규모>
구분
단위
수치
시장규모 (2024년)
US$ 천
306,400
시장규모 예측치 (2033년)
US$ 천
602,300
CAGR (2025~2033년)
%
7.2
기초 분석 연도
-
2019~2024년
[자료: IMARC Group, 일본 치과용 의료기기 시장 보고서 (제품별) (2024)]
일본의 치과용 기기 시장은 2024년 기준 약 3억640만 달러 규모에서 2033년까지 약 6억230만 달러로 성장할 것으로 전망되며, 2025년부터 2033년까지 연평균 7.2%의 견고한 성장률을 기록할 것으로 예상된다. 구강질환의 확산과 함께 개인의 구강 건강 및 예방 의식이 높아지면서 이러한 시장 성장이 예상되는 것이다. 아울러 고령 인구 증가로 인해 치과 치료 수요가 급격히 확대되고 있다. 치아 미백, 교정 등 미용 목적의 치과 치료에 대한 관심이 높아지면서 관련 기기 수요도 함께 증가하고 있다.
기술적인 측면에서는 3D 이미징, 디지털 레이저, CAD/CAM 시스템 (컴퓨터로 설계하고 제작하는 보철 시스템), 구강 스캐너 등 고정밀 진단 및 치료 장비의 도입이 활발히 이뤄지고 있다. 또한 절개를 최소화한 치료 진료와 환자 편의성을 중시하는 트렌드에 맞춰 기술 발전이 이어지고 있으며, 외국인 환자를 유치하는 덴탈 투어리즘의 확산도 시장 확대에 긍정적인 영향을 미치고 있다.
수입 동향
<일본 치과용 기기(902213) 최근 3년 수입 동향>
(단위: US$ 천, %)
순위
국가/지역
수입액
점유율
2022
2023
2024
2022
2023
2024
전 세계
38,510
32,042
19,353
100.0
100.0
100.0
1
독일
13,375
11,058
9,245
34.7
34.5
47.8
2
대한민국
11,563
8,767
6,326
30.0
27.4
32.7
3
미국
4,715
4,172
1,665
12.2
13.0
8.6
4
프랑스
3,828
4,388
1,167
9.9
13.7
6.0
5
핀란드
4,351
3,657
905
11.3
11.4
4.7
6
중국
-
-
33
-
-
0.2
7
이탈리아
677
-
12
1.8
-
0.1
* 주: 일본에서 수입하는 치과용 기기 (HS 코드 902213) 수입대상국은 위 7개가 전부
[자료: Global Trade Atlas (GTA) (2025.8.6.)]
최근 3년간 일본의 치과용 기기(HS코드 902213) 수입 동향을 살펴보면 독일이 2023년 대비 2024년에 약 13.3%의 점유율 증가를 한다. 2024년에는 전체 수입의 약 47.8%를 차지해 거의 절반에 육박하는 점유율을 기록했다. 수입액 2위를 차지한 대한민국으로부터의 수입은 2023년 소폭 감소한 이후 2024년 다시 5.3% 증가해 회복하는 양상을 보였다. 또한, 3위인 미국(8.6%)과는 큰 격차가 드러났다.
주목할 점은 2024년 기준으로 독일과 한국의 수출 비중을 합치면 약 80.5%에 달해 이 두 국가가 일본 치과용 기기 수입 시장의 대부분을 차지한다는 것이다. 이러한 시장 집중도는 일본 내 수입 시장이 특정 국가에 편중돼 있으며, 독일과 한국산 제품의 기술력과 신뢰도가 높음을 시사한다.
경쟁 동향
일본 치과기기 시장은 고도로 분절화돼 있어 다양한 국내외 기업들이 각기 다른 세부 제품군을 중심으로 활발히 경쟁하고 있다. 주요 기업들은 3D 이미징 시스템, 레이저 장비 등 첨단 기술을 접목한 혁신적인 제품을 통해 진단 정확도와 진료 효율성을 높이며 기술력과 품질을 중심으로 한 차별화 전략을 펼치고 있다. 이러한 경쟁은 고령화, 미용 목적의 치과 치료 수요 증가 등 구조적 수요 확대 요인과 맞물려 시장 성장을 견인한다. (IMARC Group, 일본 치과용 의료기기 시장 보고서 (제품별) (2024))
아래는 일본 치과기기 시장 내 대표 5개 기업의 특징과 전략을 정리한 것이다.
<일본 치과용 기기 시장 주요 5개 기업별 특징과 전략 >
기업명
특징
전략

덴츠플라이 시로나
(デンツプライシロナ)
- 미국 본사의 일본 법인
- 글로벌 치과기기 선도기업
- 영상 장비, 교정, CAD/CAM 시스템 등
폭넓은 제품군 보유
- 2021년 일본 법인 Dentsply Sirona K.K. 가 Morita Dental Products 에 인수됨
- 일본 현지 시장에 최적화된 유통 구조 확보와
협업을 통한 제품 다각화에 집중
- 기술 통합을 통해 디지털 진료 워크플로우 제공

마니
(マニー株式会社)
- 일본 토종 브랜드
- 신경치료 외과기구 등 정밀 치과기구 제공
- 정밀도 높은 일본 생산기반을 바탕으로 신뢰성 높은 제품 제공
- 국내는 물론 70여 개국 수출, 고령화로 인한 수술 수요 대응
- 고정밀 니켈-티타늄 기기 개발로 경쟁력 유지

다카라벨몬트
(Takara Belmont)
- 오사카에 자리 잡은 일본 브랜드
- 치과용 유닛체어 및 미용 의료기기 제조
- 유닛체어 + 진료대 + 조명 등 통합 설루션 제공
- 디자인, 인체공학, 위생 설계 강화를 통해 프리미엄 진료 환경 구축
- 클리닉 리모델링 및 신규 개설 수요에 강하게 대응
3M Japan
- 미국 3M의 자회사
- 소모성 치과재료(복합수지, 접착제 등)에서
글로벌 강자
- CAD/CAM 연계 가능한 디지털용 재료 개발로 디지털 덴탈 시장 강화
- 일본 내 소비자 신뢰도 높은 브랜드력 바탕으로 시장 점유율 유지
- 진료 효율성과 접착성 강화한 소재 중심의 제품군 확장

덴테크
(株式会社デンテック)
- 일본 내 소형 클리닉용 유닛체어 제조업체
- 중소형 치과 대상 저가형 장비 공급에 집중
- 고객 맞춤형 커스터마이징 → 공간 제약 있는 클리닉에 최적화
- 제품군 간결화 + 유지보수 용이성을 무기로 일본 내 점유율 확보
[자료: Mordor Intelligence, Japan Dental Equipment Market Report (2025-2030)]
덴츠플라이 시로나와 3M Japan 은 디지털 워크플로 및 소재 기술을 바탕으로 일본 시장 내 프리미엄 세그먼트를 공략하고 있다. 마니와 덴테크는 정밀 기기와 중소형 클리닉 특화 장비를 중심으로 틈새시장 전략을 전개 중이다. 다카라벨몬트는 유닛체어 중심의 통합 설루션으로 클리닉 리모델링 수요에 대응하며 경쟁력을 확보하고 있다.
유통구조
<일본 치과용 기기 유통 구조>
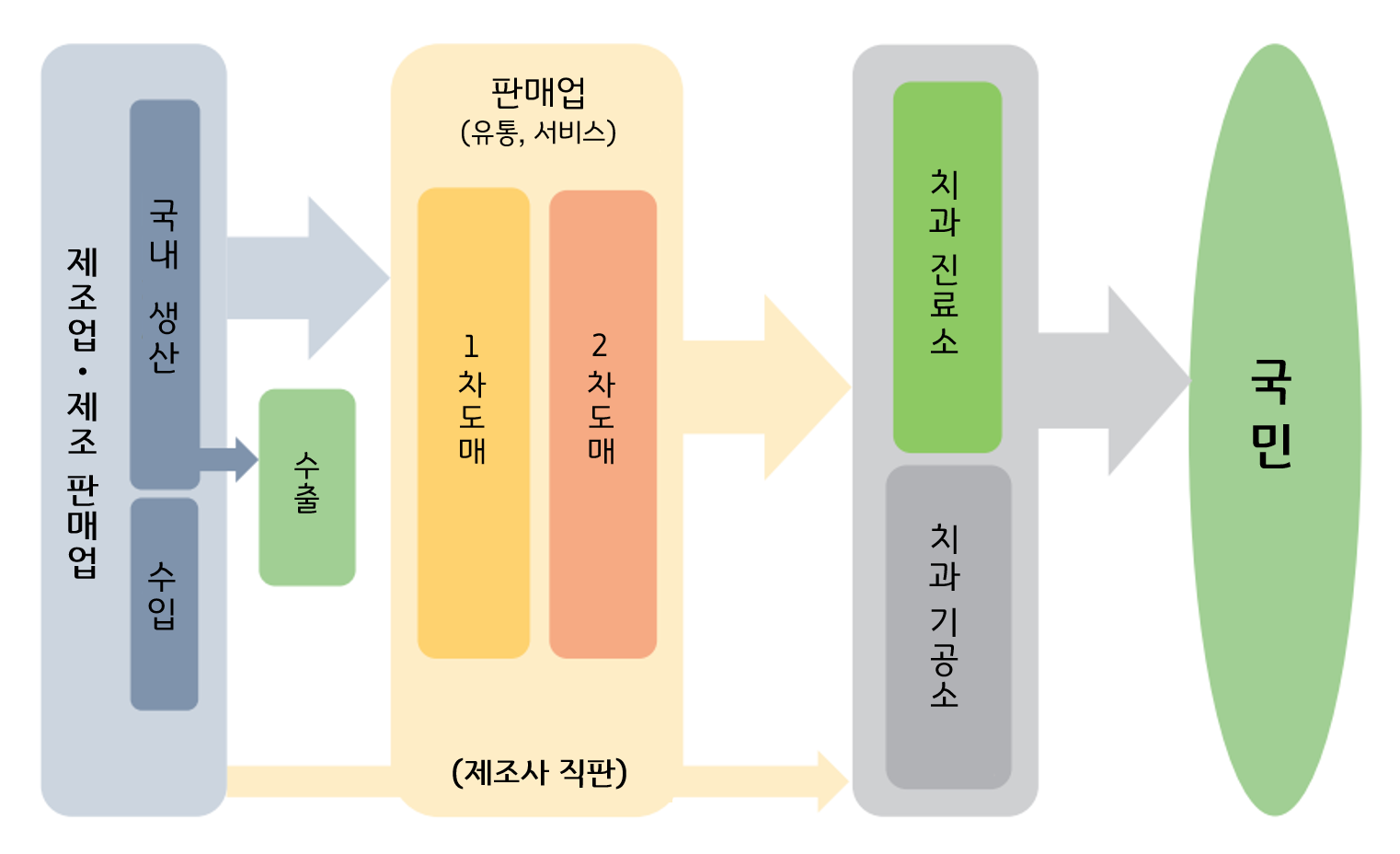
[자료: 일본치과상공협회(Japan Dental Trade Association, JDTA), 「2022년판 신(新) 치과의료기기 및 치과의료기술 산업 비전」 번역, (2023.5.)]
2025년 현재 기준 최신 자료인 일본치과상공협회의 「2022년판 신(新) 치과의료기기 및 치과의료기술 산업 비전」 보고서에 따르면, 일본의 치과용 의료기기 시장은 치과 진료소 및 기공소를 중심으로 형성된 구조적 특성이 뚜렷하다. 2021년 기준, 일본 내 치과 진료소는 총 6만7899개소에 달했다. 이 중 76.8%는 개인이 개설한 형태이고 22.3%는 의료법인에 의해 운영돼, 개인 개원 형태가 시장에서 높은 비율을 차지한다. 아울러 유통 과정에서 지역 밀착형 영업이 중요하게 작용한다. 치과의사의 지시에 따라 보철물이나 의치 등을 제작하는 치과기공소는 2020년 기준 2만0879개소가 존재했으며, 이 중 76.3%는 기공사 수 1명의 소규모 사업장이었다. 이는 일본 치과 기술 산업이 전반적으로 소규모 · 영세한 구조를 바탕으로 운영되고 있음을 보여준다.
위 보고서에 따르면, 치과용 의료기기, 의약품, 치과 전용 소프트웨어 등은 제조업체 또는 제조판매업체에서 출하된 후 1차 도매업체 및 2차 도매업체를 거쳐 전국의 치과 진료소 및 기공소에 공급되는 다층적 유통 구조를 가진다. 일본치과상공협회에 따르면, 현재 회원사로 등록된 업체는 제조업 · 제조판매업체가 261개사, 1차 도매업체가 14개사, 2차 도매업체가 507개사로 구성돼 있다. 1차 도매업체는 주로 전국 유통망을 보유한 대형 도매상이며 제품의 대량 유통과 물류를 담당한다. 2차 도매업체는 지역별 치과 병 · 의원 및 기공소에 직접 납품하고 유지보수 · 설치 등을 지원하는 역할을 수행한다. 이러한 구조는 일본 치과 산업이 지역 딜러 중심의 신뢰 기반 거래에 크게 의존하고 있다는 점을 보여준다.
관세율
<HS 코드 902213 적용 관세율>
HS Code
기본
WTO
902213
무관세
무관세
[자료: 실행관세율표 (2025. 4. 1.)]
인증
구분
인증제도
대상 기기 예시
특징
심사기관
소요기간
고위험
승인 (承認, Shonin)
- 이식형 임플란트 뼈이식재
- GBR 재료 (뼈를 재생시키는 재료)
- CAD/CAM 시스템 고출력 레이저
- 임상데이터 필수
- 가장 까다로운 심사
- 신의료기술/ 신소재 해당
PMDA + 후생노동성
9~16개월
중위험
인증 (認証, Ninsho)
- 유닛체어
- 핸드피스 구강 내 카메라
- 스케일러 치과용 CT
- 멸균기
- JIS 표준 기반
- 등록 인증기관 (RCB) 심사
- 한국산 제품 다수 해당
등록 인증 기관 (RCB)
3~5개월
저위험
신고 (届出, Todokede)
- 의료용 소프트웨어 트레이
- 라이트 스탠드
- 비의료적 구조물 등
- 신고만으로 판매 가능
- 규제 부담 낮음
- 빠른 시장 진입 가능
PMDA (신고만)
수일~1개월
[자료: 일본 의약품의료기기종합기구(PMDA) 홈페이지, KOTRA 후쿠오카 무역관 종합]
일본에서 치과용 의료기기를 시장에 출시하기 위해서는 기기의 위험도에 따라 다른 인증 제도를 통해 정부로부터 승인 또는 인증을 받아야 한다. 해당 제도는 크게 제조판매 승인(製造販売承認), 제3자 인증(第三者認証), 제조판매 신고(製造販売届出)로 구분되며, 각각 고위험 · 중위험 · 저위험 기기에 적용된다. 이들 인증 제도는 일본 후생노동성(MHLW)과 의약품의료기기종합기구(PMDA), 그리고 등록 인증기관(RCB) 등 관계 기관의 심사 · 관리하에 운영된다. 이는 의료기기의 안전성과 유효성을 확보하기 위한 핵심 규제 체계로 자리 잡고 있다.
① 승인 (承認) – 제조판매 승인 제도
승인 제도는 환자의 생명과 직결되는 고위험 치과용 의료기기에 적용되는 가장 엄격한 규제 절차이다. 이식형 임플란트, 뼈이식재, GBR 재료, CAD/CAM 시스템 고출력 레이저 등은 해당 절차를 반드시 거쳐야 한다. 심사는 PMDA 에서 수행되고, 최종 승인은 후생노동성이 담당한다. 제품의 기술 수준과 혁신성에 따라 신의료기기, 개량의료기기, 후발의료기기로 분류되며 그에 따른 심사 기간은 평균 9~16개월이다.
<승인 유형별 특징 요약>
구분
정의
심시기간
비고
신의료기기
구조, 사용방법, 성능 등이 기존과 현저히 달라
새로운 기술로 간주하는 제품
평균 12개월
(우선심사 시 9개월)
혁신적 기술 포함 시 해당됨
개량의료기기
기존 제품과 일부 차별성이 있는 제품
임상시험 있음 : 9개월
임상시험 없음 : 6개월
신기술은 아니나 기존 제품과 차이 있음
후발의료기기
기존 승인 제품과 실질적으로 동일한 제품
평균 4개월
기존 승인 제품 기준 적용 가능
[자료: 일본 의약품의료기기종합기구(PMDA), 승인에 대해 (대신 승인)]
의료기기 승인 절차는 기기의 혁신성 및 유사성에 따라 세 가지로 구분된다. 첫째, 신의료기기(新医療機器)는 구조, 사용 방법, 성능 등이 기존과 현저히 달라 새로운 기술로 간주되는 제품이다. 평균 12개월의 심사 기간(우선심사 시 9개월)이 소요된다. 둘째, 개량의료기기(改良医療機器)는 기존 제품과 일부 차별성이 있는 제품으로 임상시험 필요 여부에 따라 심사 기간이 6~9개월이다. 마지막으로 후발의료기기(後発医療機器)는 기존 승인 제품과 실질적으로 동등한 제품으로 평균 4개월의 심사 기간을 가진다.
승인 과정에서 제출된 시험자료의 신뢰성을 검토하기 위해 기준적합성조사(信頼性調査)가 수행된다. 제조 공정 및 품질관리 시스템이 적절한지 확인하는 QMS 조사 (품질관리체계)도 병행된다. 소프트웨어 기반 치과 기기라면 프로그램 의료기기(プログラム医療機器)로 분류돼 환자 건강에 미치는 영향에 따라 별도의 평가 기준이 적용된다. 일부 중소 · 벤처 기업 및 소아용 의료기기에 대해서는 승인 수수료 보조제도 또한 마련돼 있다. 이러한 체계적인 심사 · 조사 절차를 통해 일본은 의료기기 승인에 있어 안전성과 신뢰성을 확보한다. 치과용 기기도 이 기준에 따라 관리된다.
② 인증 (認証) – 제3자 인증 제도
인증은 중위험 의료기기에 적용된다. 등록 인증기관(RCB)이 JIS 기준을 바탕으로 심사한다. 해당 기관은 후생노동성에 등록돼 있다. 인증 가능 품목은 기관별로 상이할 수 있다. 인증 심사 결과는 PMDA를 통해 공시되며 인증 변경 또는 취소도 동일하게 보고된다.
이 절차는 승인 제도에 비해 비교적 소요 기간이 짧고 일부 제품은 이 절차를 통해 시장에 유통된다. 다만, 각 제품의 인증 가능 여부 및 심사기관의 범위를 사전에 확인할 필요가 있다.
③ 신고 (届出) – 제조판매 신고 제도
신고는 저위험군(Class I)에 해당하는 치과용 의료기기에 적용되는 가장 간소한 규제 절차이며 신고만으로 시장 유통이 가능하다. 트레이, 라이트 스탠드, 의료용 소프트웨어, 비의료적 구조물 등은 여기에 포함되며, PMDA에 제출된 신고서 접수만으로 제품 판매가 가능하다. 각 제품은 ‘일물일신고(一物一届)’ 원칙에 따라 고유 판매명으로 신고해야 한다. 심사나 인증 절차가 생략되므로, 통상적으로 수일~1개월 이내에 시장 진입할 수 있어 초기 시장 반응을 확인하거나 니치한 제품 출시 시 전략적으로 활용된다. 그러나 신고 오류 발생 시 법적 책임이 따르므로 신고 내용의 정확성이 매우 중요하다.
시사점
일본 치과기기 시장은 고령화와 미용 목적의 치과 치료 수요 증가에 따라 안정적인 성장세를 보이며 고도 기술 기반 제품과 저가형 장비 간의 이원적 수요가 공존한다. 수입 시장은 독일과 한국이 전체의 80% 이상을 차지해, 소수 국가에 높은 의존도를 보이는 구조이다. 복잡한 인증 제도와 지역 중심 유통 구조는 시장 진입 시 전략적 대응이 필요한 요소로 작용한다. 다만, 치과용 의료기기의 경우 일본 수출을 위해서는 복잡한 인증 및 승인 절차를 거쳐야 하므로 철저히 준비한 다음 시장에 진입하는 과정이 필요할 것으로 보인다.
자료: IMARC Group, Global Trade Atlas (GTA), Mordor Intelligence, 일본치과상공협회 (Japan Dental Trade Association, JDTA), 후생노동성, 일본 관세청 (Japan Customs), 일본 의약품의료기기종합기구 (PMDA) 종합, KOTRA 후쿠오카 무역관 종합
<저작권자 : ⓒ KOTRA & KOTRA 해외시장뉴스>

KOTRA의 저작물인 (일본 치과용 기기 시장 동향)의 경우 ‘공공누리 제4 유형: 출처표시+상업적 이용금지+변경금지’ 조건에 따라 이용할 수 있습니다. 다만, 사진, 이미지의 경우 제3자에게 저작권이 있으므로 사용할 수 없습니다.
-
1
스웨덴 로봇산업, 국가의 성장동력으로 작동하다
스웨덴 2025-08-01
-
2
2025 벨라루스 가전산업 정보
벨라루스 2025-09-05
-
3
미국 컴퓨터 모니터 시장동향
미국 2025-09-12
-
4
2025 인도 신발산업 정보
인도 2025-09-16
-
5
중국 스마트 센서 시장 동향
중국 2025-09-12
-
6
중국 산업용 로봇 시장 동향
중국 2025-09-09
-
1
2025년 일본 조선업 정보
일본 2025-10-16
-
2
2025년 일본 농산물 산업 정보
일본 2025-07-03
-
3
2024년 일본 에너지산업 정보
일본 2024-11-19
-
4
2024 일본 리튬이온 전지 산업 정보
일본 2024-11-18
-
5
2021년 일본 석유산업 정보
일본 2022-01-20
-
6
2021년 일본 의료기기 산업 정보
일본 2022-01-20
- 이전글
- 다음글













