-
전문가 인터뷰로 확인한 미국 ‘화장품 규제 현대화법(MoCRA)’
- 통상·규제
- 미국
- 로스앤젤레스무역관 김서원
- 2024-06-19
- 출처 : KOTRA
-
7월부터 화장품 시설 및 제품 등록의무 규정 공식 발효
등록은 웹사이트로 가능하나, 미국 대리인 반드시 필요
FDA 수입경보 조치 사례 빈번… 철저한 규정 숙지는 필수
7월 1일까지 MoCRA 시설 및 제품 등록 필수
다가오는 2024년 7월 1일, 미국 식품의약국(이하 FDA)의 ‘화장품 규제 현대화법(MoCRA·The Modernization of Cosmetics Regulation Act of 2022)’의 시설 및 제품 등록 의무화를 포함한 대부분의 규정이 완전 발효된다. MoCRA는 1938년 제정된 ‘연방 식품, 의약품 및 화장품법(The Federal Food, Drug, and Cosmetic Act)’ 이후 84년 만에 바뀐 규제다. 화장품 규제에 대한 미국의 가장 큰 변화인 만큼 KOTRA 로스앤젤레스 무역관은 우리 기업의 혼선을 최소화하고자 2023년부터 세 번에 걸쳐 관련 기사를 게시했다. 본 기사 하단 ‘관련 뉴스’에서 확인 가능하다.
MoCRA의 주요 규정은 크게 7가지다. △시설 및 제품 등록 의무화(Mandatory Facility Registration and Product Listing), △제품 안전성 입증(Safety Substantiation), △라벨링 규제(Labeling), △우수 제조 관행 가이드라인 표준화(Good Manufacturing Practice), △유해 사례 보고 및 관리(Adverse Event Report and Keeping), △회수 처리(Recall), △활석 및 과불화화합물 함유(Talc and PFAS) 등이 주요 내용이다.
이 중 ‘시설 및 제품 등록 의무화’ 규정의 경우 당초 2023년 12월 29일부 발효 예정이었다. 그러나 FDA가 화장품 업계 의견을 수렴해 업계가 새로운 의무 사항을 이행하는데 어려움을 완화하고자 2024년 7월 1일로 발효일을 6개월 연기했다. 기한 연장을 통해 규제 당국이 업계에 새로운 규제를 준비할 시간을 추가로 제공한 만큼, 규제 위반 시 제재 조치가 더욱 엄격해질 것이라는 게 업계의 일반적인 시각이다.
<미국 FDA 발표 화장품 규제 현대화법 시행 일정>
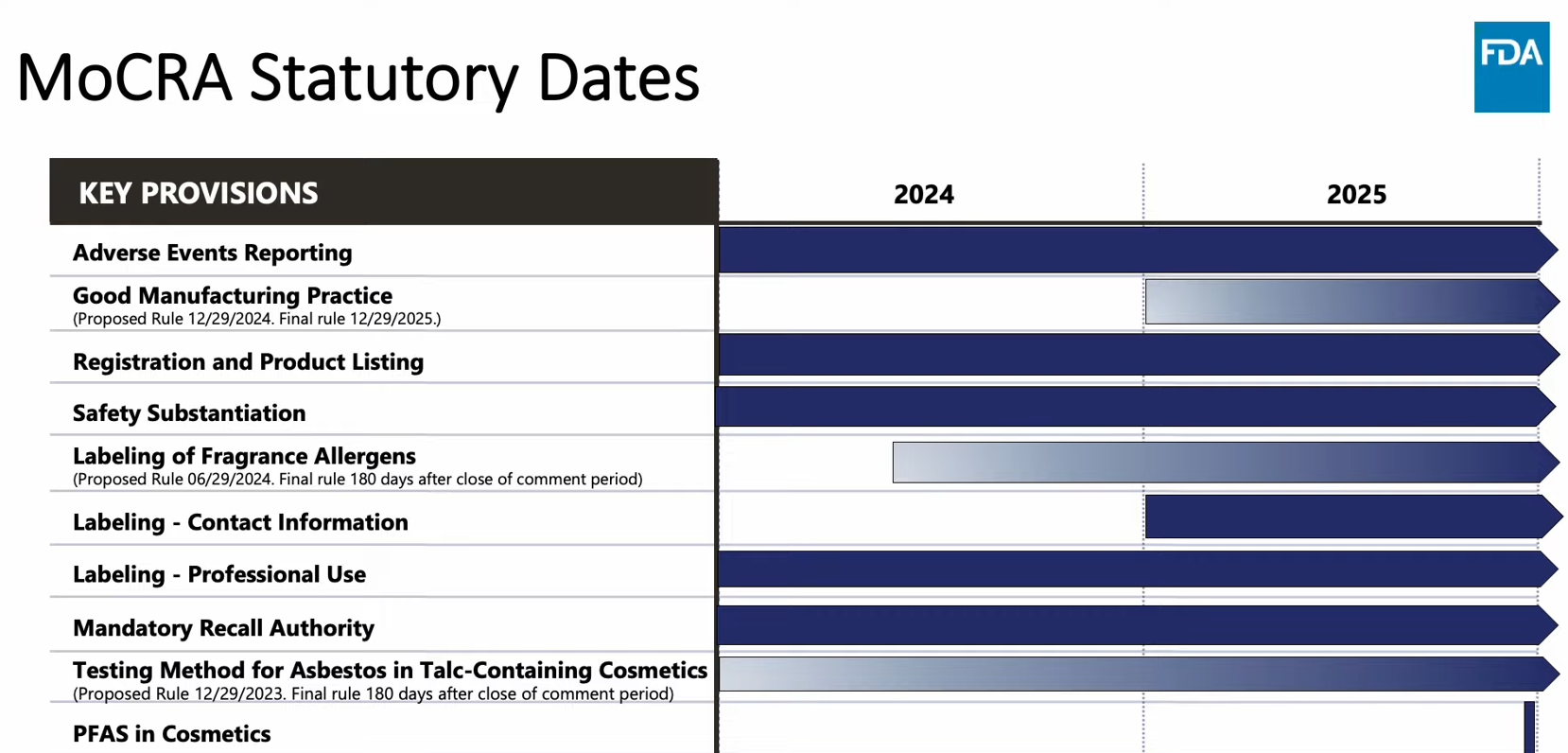
*’23.4월 발표 자료로 이후 ‘시설 및 제품 등록(Registration and Product Listing)’ 기한이 ’24.7.1일까지로 연장됨.
[자료: FDA]
업계 전문가와 MoCRA 10문10답
KOTRA 로스앤젤레스 무역관은 최근 MoCRA에 대한 고객 문의 증가에 대응하고자 업계 전문가 두 명과 인터뷰를 진행했다. MoCRA 시행에 대비해 화장품 기업에 통관과 물류 컨설팅 서비스를 제공하고 있는 미국 물류 기업 CGETC Inc의 데이비드 변(David Byun) 대표와 미국 롱비치 소재 관세사무소 VIP Customs Service의 제인 킴(Jane Kim) 관세사가 풍부한 기업 지원 경험과 전문성을 바탕으로 인터뷰에 참여했다. 답변에서 데이비드 변 대표는 '변(Byun)', 제인 킴 관세사는 '김(Kim)'으로 표기했다.
Q1: 당장 7월 1일부터 의무화되는 시설 등록은 한번만 하면 되나요? 그리고 어떤 사항을 등록하나요?
김(Kim): 아닙니다. 시설 등록은 2년에 한 번 등록을 갱신해야 합니다. 또한 2년이 되지 않았더라도 기존 사항에 변경이 있는 경우 60일 이내에 내용을 업데이트해야 합니다. FDA 화장품 시설 등록 시 필요한 사항들은 다음과 같습니다.
a. 시설 이름, 실제 주소, 이메일 주소 및 전화번호
b. 해외 화장품 시설의 경우 미국 대리인(US Agent) 정보
c. FDA에서 이전에 할당한 화장품 시설 등록 번호 (있는 경우에 한함)
d. 시설에서 제조 또는 가공되는 화장품의 모든 브랜드 이름
e. 시설에서 제조 또는 처리되는 각 화장품의 제품 카테고리 및 책임자(Responsible Person)
Q2: 책임자와 미국 대리인은 서로 다른 것인가요?
김(Kim): 책임자는 라벨에 이름이 표시된 화장품의 제조업체, 포장업체, 유통업체를 말합니다. 책임자는 이제 시판되는 모든 제품을 출시 후 120일 이내에 FDA에 제품을 리스팅해야 하며, 제품 성분을 포함한 정보를 매년 업데이트해야 합니다. 제품 리스팅 시 필요한 사항들은 다음과 같습니다.
a. 화장품을 제조, 가공하는 각 시설의 등록번호
b. 책임자의 성명, 연락처, 화장품의 명칭
c. 화장품의 카테고리
d. 향료(Fragrances), 향(Flavor) 또는 색상(Color)을 포함한 화장품 성분 목록
e. 과거 FDA에서 지정한 제품 목록 번호 (있는 경우에 한함)
Q3: 미국 대리인이 반드시 있어야 하나요? 음성사서함(voice mail)으로 대체하는 것은 안 되나요?
변(Byun): 음성사서함으로 대체될 수 없습니다. 미국 대리인(US Agent)은 반드시 미국에서 상시 거주하고 있는 사람이나 회사여야 합니다. 미국 대리인은 수출 기업 입장에서도 통관 시 문제가 발생하면 대응에 필요합니다. 미국 대리인이 없어 FDA와 제대로 된 의사소통이 이뤄지지 못해 FDA의 수입경보(Import Alert)를 받아 수출길이 막히게 되는 경우도 많습니다. FDA는 수입경보 사례를 경보 종류, 일자, 국가별로 웹사이트에 공개하고 있습니다. 수입경보 사례 정보는 웹사이트(https://www.accessdata.fda.gov/cms_ia/default.html)에서 확인할 수 있습니다. 웹사이트를 조회해 보면, 한국 기업에도 ‘검사 없이 억류 조치(DWPE·Detention Without Physical Examination)’가 걸려 있는 경우가 상당히 많다는 것을 확인할 수 있습니다.
Q4: 수입경보 DWPE를 언급하셨는데요, 자외선 차단제를 수출하려던 우리 기업이 ’66-41. 미국에서 판촉된 승인되지 않은 신약에 대한 제품에 대한 검사 없이 억류 조치’를 받은 적이 있습니다. 자외선 차단제가 미국에선 의약품으로 분류되나요?
변(Byun): 네. 자외선 차단제와 같이 의약품 성분을 포함하는 화장품은 의약품으로도 규제 받을 수 있습니다. 'K-뷰티' 열풍으로 미국에서 인기를 얻고 있는 한국 화장품 중 자외선 차단제 비중이 높은 만큼 이에 대한 주의와 대책이 필요합니다. 제품의 구별은 제품의 책임자가 제품의 '의도된 용도(Intended use)'를 어떻게 주장하는가에 따라 달라질 수 있습니다. 제품 홍보 목적으로 자외선 차단 성분이나 SPF를 라벨링에 강조하는 경우가 많은데, 이 경우 의약품으로 분류돼 규제될 것입니다.
Q5: 시설 및 제품 등록은 전문 대행사 등을 거쳐야 하나요?
변(Byun): 아니오. 직접 웹사이트를 통해 할 수 있습니다. FDA에서 운영하는 전자등록 플랫폼인 ‘Cosmetics Direct(https://direct.fda.gov/apex/f?p=100:LOGIN_DESKTOP)’에서 계정을 만든 후 직접 등록하면 됩니다. 다만 등록 정보에 거짓이나 오류가 있는 경우 이에 대한 책임이 있음을 염두에 두시고 전문가와 충분한 상담 후 진행하는 것을 권합니다. 혹시 FEI 시설 등록이 되지 않았다면, Cosmetics Direct에 시설 등록을 하기에 앞서 FEI(https://www.accessdata.fda.gov/scripts/feiportal/index.cfm?action=portal.login)에서 시설 등록 번호를 받아야 합니다.
<시설 및 제품 등록을 위한 전자등록 플랫폼 Cosmetics Direct 화면>
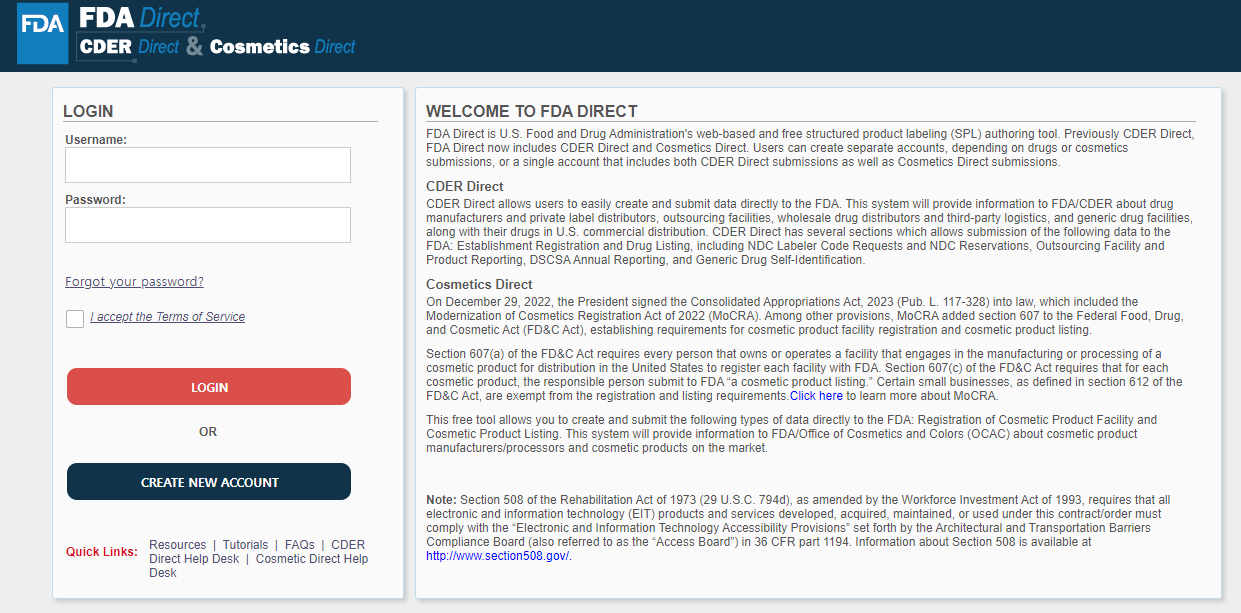
[자료: FDA Cosmetics Direct(https://direct.fda.gov/apex/f?p=100:LOGIN_DESKTOP)]
Q6: 우수 제조 관행 가이드라인(GMP·Good Manufacturing Practice)는 무엇인가요?
김(Kim): MoCRA에 따라 FDA는 이제 화장품 제조 및 가공 시설에 대한 우수 제조 관행(GMP) 가이드라인을 공포해야 합니다. 아직 발표하진 않았지만 FDA는 MoCRA 제정 후 2년 이내에 제안 규칙을 발표하고, 늦어도 제정일로부터 3년이 되는 2025년 12월 29일 전에는 최종 규칙을 발표할 것입니다. GMP를 수립할 때 FDA는 사업체의 규모와 범위, 그리고 화장품이 공중 보건에 미치는 위험을 고려하겠죠. 그리고 이 GMP를 충족하지 않는 조건에서 제조 또는 가공된 화장품은 불량한 제품으로 간주될 것입니다. 그리고 FDA는 시설이 GMP를 제대로 준수하고 있는지 확인하기 위해 시설을 직접 방문하여 검사할 수 있는 권한이 있습니다.
Q7: FDA에서 제조시설을 방문하여 검사할 수 있는 권한은 MoCRA 이전에도 있었던 것 같은데요. 해외에 실제로 나와서 검사를 한 사례가 있나요?
변(Byun): 네, 제조시설이 해외에 있어도 예외는 아닙니다. 미국 FDA에서 직접 한국 공장에 해외 출장을 와 현장 감사를 한 사례는 꾸준히 있었습니다. 회사 규모와 무관하게 FDA에서 현장 감사를 실시하고 있습니다.
Q8: MoCRA는 일부 소기업에 대해선 시설 등록 및 제품 리스팅 의무를 면제해주지 않나요?
김(Kim): 맞습니다. 미국 내 화장품 제품의 평균 총 매출이 최근 3년간 100만달러 미만인 소기업에 대해선 시설 등록 및 제품 리스팅 의무가 면제됩니다. 그러나 아래와 같은 제품을 취급하는 업체들은 규제 면제가 적용되지 않습니다. 마지막 d 유형의 경우 반영구 화장품, 타투, 반영구 립 컬러 등을 생각하면 됩니다.
a. 일반적이거나 통상적인 사용 조건에서 점막과 정기적으로 접촉하는 화장품
b. 체내 주사하는 화장품
c. 체내 사용을 목적으로 하는 화장품
d. 소비자가 직접 제거하지 않는 경우 24시간 이상 외모에 변화를 주도록 의도된 화장품
<소기업 규제 면제가 적용되지 않는 눈썹문신 등 반영구화장품>
[자료: Pixabay]
Q9: 라벨링 규정은 어떤 내용인가요?
김(Kim): 만약 '향료 알러전(Fragrance Allergen)'이 포함된 경우 해당 알러젼을 라벨에 업데이트해야 합니다. 또한 해당 제품이 면허가 있는 전문가만 관리 또는 사용할 수 있다면 그러한 사실(The product shall be administered of used only by licensed professionals)을 라벨에 명시해야 합니다. 이는 2024년 7월 1일 부로 정식 발효되는 사항입니다. 다만, 라벨에 미국 내 주소, 책임자가 부작용 보고를 받을 수 있는 미국 내 전화번호 또는 웹사이트를 포함하는 전자 연락처 정보를 넣어야 하는 의무이행은 2024년 12월 29일까지 연장된 상태입니다.
Q10: 만약 라벨에 문제가 있어서 통관에서 걸리면 어떻게 하나요?
김(Kim): 만약 물건이 통관 검역(exam)에 걸린 경우, 관세사를 통해 미국 대리인(US Agent)을 바로 찾는 게 가장 중요합니다. 검역 대상으로 구분되는 경우에는 대부분 30일 가량의 대응 시간을 주기 때문에 미국 대리인을 통해 FEI 번호가 없다면 FEI 번호를 발급받고, 한국의 사업자 등록 번호에 상응하는 DUNS 번호가 없다면 DUNS 번호를 받아 통관 진행이 가능합니다. 검역 대상으로 조치된 경우, FDA에서 조치 통지서(Notice of Action)를 보냅니다. 그 통지서에는 FDA 담당 심사관(FDA Compliance Officer)의 전화번호와 이메일 주소가 적혀져 있고, 어떤 이유로 보류된 것인지 보류 이유가 기재돼 있습니다. 이 때 수입자나 수출자가 직접 연락하는 것보단 관세사를 통해 조치 통지서를 검토하고 소통하는 것을 추천합니다.
시사점
한류 열풍으로 K-뷰티에 대한 미국 소비자의 관심도 어느 때보다 뜨거운 가운데, 점점 많은 우리 화장품 기업들이 미국 진출에 도전하고 있다. 이 기업들이 첫 번째 해야 할 일은 다가오는 7월 1일까지 사업체와 제조시설을 FDA에 등록하는 것이다. 이미 등록을 마친 기업이라도 변경 사항이 발생했다면 60일 이내에 갱신이 필요하다. 만약 MoCRA 규정 준수가 제대로 이뤄지지 않아 FDA로부터 수입경보(Import Alert)을 받게 되면 해당 문제를 해결하더라도 향후 통관 절차가 지연되는 등 비즈니스에 어려움을 겪을 수 있다. 이러한 상황을 방지하기 위해 FDA의 가이드라인에 대한 철저한 숙지가 필요하다. 또한 가짜 속눈썹이나 가짜 손톱 스티커 등 가이드라인 상에선 MoCRA 등록 대상인지가 불분명한 회색 지대 상품에 대해서도 실제론 FDA측에서 등록을 요구하는 등 현장 애로사항이 빈번히 발생하고 있기 때문에 업계 전문가와의 사전 상담을 충분히 진행해 새로운 규제에 빠른 대응을 하는 것이 중요하다.
자료: FDA, Congressional Research Service, 그 외 전문가 인터뷰 등 KOTRA 로스앤젤레스 무역관 자료 종합
<저작권자 : ⓒ KOTRA & KOTRA 해외시장뉴스>

KOTRA의 저작물인 (전문가 인터뷰로 확인한 미국 ‘화장품 규제 현대화법(MoCRA)’)의 경우 ‘공공누리 제4 유형: 출처표시+상업적 이용금지+변경금지’ 조건에 따라 이용할 수 있습니다. 다만, 사진, 이미지의 경우 제3자에게 저작권이 있으므로 사용할 수 없습니다.
-
1
MoCRA 완전 발효 앞둔 美, 화장품 관련 규제 다시 보기
미국 2024.04.08
-
2
美 FDA, 화장품규제 현대화법(MoCRA) 일부 발효 연기
미국 2023.11.23
-
3
[기고] 새로운 美 '화장품규제 현대화법(MoCRA)' 12월 29일 발효 예정
미국 2023.05.15
-
1
MoCRA 완전 발효 앞둔 美, 화장품 관련 규제 다시 보기
미국 2024-04-08
-
2
미국 '자동 긴급 제동장치(AEB)' 의무화
2024-06-19
-
3
전기차 산업의 블루오션, 중국 전고체 배터리 시장
중국 2024-06-19
-
4
일본 초고령사회 해법, 헬스케어 스타트업에서 찾는다
일본 2024-06-18
-
5
갑작스러운 미국 해상 물류 운임 급등의 원인은?
미국 2024-06-25
-
6
[기고] 새로운 美 '화장품규제 현대화법(MoCRA)' 12월 29일 발효 예정
미국 2023-05-15
-
1
2021년 미국 사이버 보안 산업
미국 2022-01-04
-
2
2021년 미국 의류 산업 정보
미국 2022-01-03
-
3
2021년 미국 엔터테인먼트 및 미디어 산업 정보
미국 2021-12-30
-
4
2021년 미국 자동차 산업 정보
미국 2021-12-30
-
5
2021년 미국 석유 및 정유 산업 정보
미국 2021-12-30
-
6
2021년 미국의 반도체 장비 산업 정보
미국 2021-12-30













