-
탄자니아 동물용 의약품 등록 및 수입절차
- 트렌드
- 탄자니아
- 다레살람무역관 전우형
- 2018-01-19
- 출처 : KOTRA
-
- 병아리 및 닭고기 수입금지 조치 단행 -
- 현지 축산업 투자 증가로 동물용 의약품 수요 증가 예상 -
본 해외시장뉴스는 탄자니아 식약청(TFDA)의 가이드라인을 참조하고, 해당 기관을 유선 접촉해 얻은 정보로 구성돼 있다. 해당 내용에 법적 구속력이 없으므로 단순 참고용으로 사용하시기 바란다.
□ 탄자니아 동물용 의약품 개요
ㅇ 동물용 의약품(veterinary pharmaceutical product) 정의Means any substance or mixture of substances manufactured sold or represented for use in:
(a) The diagnosis, treatment, mitigation or prevention of a disease, disorder, abnormal physical or mental state, or the symptoms thereof, in animals;
(b)Restoring, correcting or beneficial modification of organic or mental functions in animals;
(c) Disinfection in premises in which veterinary medicines are manufactured, prepared or kept, ambulatory services, veterinary clinics, veterinary facilities and equipment;
(d) Articles intended for use as a component of any article specified in clause (a), (b) or (c); but does not include veterinary medical devices or their components, parts or accessories.자료원: TFDA(Guideline for veterinary pharmaceutical products)
- 아래의 목적을 위한 사용에 대표되거나 제조돼 판매되는 모든 성분 또는 성분의 조합
(a) 동물의 질병, 장애, 비정상적인 신체 또는 정신 상태나 증상의 진단, 치료, 완화, 예방 목적
(b) 동물의 기관적 또는 정신적 기능의 회복, 교정 및 개선 목적
(c) 동물용 의약품이 제조, 준비, 보관되는 곳 또는 수의 진료소, 클리닉, 동물용 편의시설 및 장비의 살균 목적
(d) 동물용 의료기기, 부품, 부대용품을 제외하고 (a), (b), (c)에 명시된 모든 물품의 성분
□ 동물용 의약품 등록
ㅇ TZ 등록기관
- 탄자니아 식약청(TFDA, www.tfda.or.tz) 다레살람본부
- 주소: P.O. Box 77150, EPI Mabibo, Off Mandela Road, Dar es Salaam
- 전화: +255-22-245-0512/0751/2108- 팩스: +255-22-245-0793
- 고객문의전화: +255-743-110974- 이메일: info@tfda.go.tz, mis@tfda.go.tz
ㅇ 등록 규정
- 미등록 의약품은 탄자니아 내에서 판매, 공급, 수입이 금지됨.
- 등록자는 탄자니아 시장에서 제품에 대한 책임 의무
- 등록예정 의약품은 아래 조건을 만족해야 함.① 약품의 유용성이 공익(public interest) 추구 범위 내에서 이루어져야 함.
② 약품은 안전하고, 효과적이며 합격 품질수준(acceptable quality)이어야 함.
③ 약품의 제조업체 구내, 생산 시설(Premises and manufacturing operations)이 현 시행중인 의약품 제조품질 관리기준(Good Manufacturing Practices: GMP)을 만족시켜야 함.
④ 이외에도 의약품은 당국의 규정사항을 만족하는 제품이어야 함.자료원: Tanzania Food, Drugs and Cosmetics Act 2003
ㅇ 등록자 요건(TFDA 유선확인 결과)
- 현지기업 등록 및 탄자니아 내 등록된 물류창고(warehouse)또는 점포(store) 보유
· 외국기업은 현지 대리인을 통해 등록 가능
- 제품등록자가 Recommendation Letter를 TFDA에 보내면 타 수입자도 제품 수입 가능
ㅇ 등록 절차
- 등록비용, 샘플, 가이드라인에 제시된 모든 서류와 함께 TFDA에 등록 신청서 제출
- TFDA는 신청서 검토 중 GMP 검사 또는 의약품 연구실 조사 요구 및 비용 청구 가능
- 등록 여부 발표 이후 이의제기는 발표일로부터 60일 이내이며 TFDA는 재검토절차 수행
- 등록 절차는 수입제품의 경우 240일, 현지 제조품은 120일 소요
- 등록증은 발급 후 5년간 유효하며 매년 등록 유지비용 지불 필수
ㅇ 등록 문서 양식
- 등록 문서 양식은 ICH에서 채택한 CTD(Common Technical Document: 의약품 국제공통기술문서)에 의거
- 모듈별 구체적 양식은 TFDA홈페이지의 'Guideline for submission of documentation for registration of veterinary medicines' 참고 요망1부: 신청내용 및 행정정보(ADMINISTRATIVE INFORMATION)
2부: 품질 평가자료 요약(OVERVIEWS AND SUMMARIES)
3부: 품질 평가자료(QUALITY INFORMATION)
4부: 비임상 연구자료(NONCLINICAL STUDY REPORTS)
5부: 임상 연구자료(CLINICAL STUDY REPORTS)
ㅇ 등록 시 제출자료
- 등록 목적에 대한 레터(Motivation Letter)(탄자니아 내 판매 허가보유자로부터 서명 필수)
- 의약품 증명서(Certificate of Pharmaceutical Product: CPP) 또는 WHO 증명서 서식에 따라 원산지국 기관의 발급 증명서
- 의약품 제조품질 관리기준(Good Manufacturing Practice)은 모든 의약품의 생산 공정은 TFDA의 GMP 가이드라인 기준에 부합하는 공장에서 생산, 공정돼야 하며 WHO 서식의 GMP증명서 제출 필요(WHO type certificate of GMP)
- 제품 샘플: 전체 용량이 캡슐·알약류 200개, 액상 의약품(liquid preparations)류 400ml, 크림 및 연고류 250g 이상인 1batch당 최소 규모의 상업용 패키지 샘플 5개 제출
ㅇ 등록 및 기타 비용
번호
내용
국내제품(달러)
수입제품(달러)
1
등록비용
500
2,000
2
변경-Major
100
300
3
변경-Minor
50
1,000
4
유지비용
150
300
5
증명서 재발급비용(Duplicate Certificate)
50
100
6
등록 신속 지원(Fast track registration-Pharmaceuticals)
해당없음
Double
자료원: Tanzania Food, Drugs and Cosmetics(Fees and Charges) Regulations, 2015
□ 등록 갱신절차
ㅇ 갱신 절차
- 등록 만료 최소 90일 이전에 갱신 신청 필수
- 접수 즉시, 신청 승인 레터(acknowledgement letter), 조회번호(reference number)부여
- TFDA는 신청자에게 추가정보 요구 가능하며 추가정보는 요구일로부터 60일 이내에 제출
- 갱신절차가 완료되면 새로운 등록 증명서가 발급됨.
ㅇ 제출 필요 자료
- 갱신 가이드라인 및 의약품 등록 가이드라인에 따라 모든 필요 서류 제출
- TFDA 의약품 제조품질관리기준(Good Manufacturing practice; GMP)을 만족시키는 증빙 제출
- 제품등록 기간 도중 제품이 검토, 승인된 모든 국가 목록 및 등록번호 제출 필요, 가능시 등록 증명서 제출
- 샘플: 묶음(batch) 1개의 최소 규모 포장 상품의 샘플 2개(two samples of the smallest commercial packs) 와 batch 분석 증명서(batch certificates of analysis)제출- 아래 의약품 분류에 따라 제출 서류 참고
① 원료 의약품(Active Pharmaceutical Ingredients: APIs)
- 원료 의약품 공급자의 이름과 주소
- 원료 의약품의 제조 증명서(manufacturing certificate), GMP 증명서(GMP certificate)- 날짜(dated), 번호 등록(numbered), 서명(signed)이 명시된 설명서 사본 및 완제품 제조자에 의해 진행된 원료 의약품 시험의 분석 절차(analytical procedures) 서류
- 원료 의약품의 포장재 설계(container-closure system)정보, 보관 조건, 원료 의약품별 재검사기간(re-test period) 및 유통기한(shelf life) 정보
② 완제 의약품(Finished Pharmaceutical Product: FPP)
- 제형의(unit dosage form) 질적, 양적 구성에 대한 상세 설명 및 상업용 묶음 사이즈(commercial batch size)에 대한 상세 설명(TFDA Guideline 3.2.P.1참고)
- 갱신서류 제출이전 시점에서 6개월 이내 제조된 최대규모 생산배치(largest production batch) 제조기록(Batch Manufacturing Record: BMR) 사본
- 갱신서류 제출이전 시점에서 최근 36개월 내에 제조된 완제품의 모든 배치(batch)에 대한 연간 품질검사 보고서
- 서명(signed), 날짜(dated), 버전이 명시돼있고(version numbered), 유통기한이 적힌 완제품 설명서 사본, 표준 시험 절차(standard testing procedures) 사본
- 포장재 설계(container-closure system) 정보(TFDA Guideline 3.2.P.7 참고)
- 안정성 연구(stability study) 자료(TFDA Guideline 3.2.P.8 참고)
- 등록기간 제품의 변형(variation) 내역자료원: Guidelines on submission of documentation for renewal of registration of human and veterinary pharmaceutical products
ㅇ 갱신 신청 서류양식
- 내용물은 A4용지(80g/㎡) 종이에 폰트 사이즈 12로, 모든 서류는 순서에 따라 정렬
- 첨부서류(covering letter)와 신청서 양식은 하드카피 제출, 모든 서류는 CD-ROM또는 전자양식으로도 제출
- 언어: 영어
ㅇ 갱신 비용: 등록비용과 동일
□ 수입 절차
ㅇ 수입 전
- 수입자는 사전 등록 필요
- 수입자는 통관절차 처리 위해 허가된 통관대리인(Clearing and Forwarding Agent) 지정 필요
- 수입 시 기본 필요 서류· 최종 송장(Final Invoice)
· 수입자의 권한 위임장(Agent's Authorization Letter from the Importer)
· TFDA 로부터의 수입허가서(Import Permits from TFDA)
· 면제서류(Exemption documents, if applicable)
· 포장 명세서(Packing List)
· 운송서류(Transport documents)(항공화물운송장, 도로화물운송장, 선하증권)자료원: TRA Import Procedure
ㅇ 수입자 분류
① 일반적 경우
- 정부, 비정부 기관·의약품 도매업체·의약품 제조업체
- 임상실험 후원자 및 연구자(Clinical trial sponsors and principal investigators)
- 의약품 증여의 수혜자② 특이 경우(special circumstance)
- 개인적 사용 목적으로 수입을 허가 받은 개인
- 병원내 사용 목적으로 수입을 허가 받은 병원
ㅇ 수입 프로세스
① 수입 신청자는 수입자(Importer)로 TFDA 사전등록 필요
② 모든 의약품은 수입 전 TFDA에 등록 필수
③ 공인 수입자는 TFDA에 수입신청서 제출
④ 수입 신청서는 TFDA 본사 혹은 Arusha, Mwanza, Mbeya, Dodoma 지역사무소에 제출 가능
⑤ 신청서에는 수입업체 담당 전문 약사 또는 수의사, 또는 수입신청자의 도장 또는 서명 날인
⑥ 수입허가는 6개월간 유효
⑦ 수입허가는 1회 적하품에 한해 적용되나 분할 선적의 경우 2회 적하품까지 적용상업 송장(Proforma invoice) 필수 포함 내용
- 송장번호, 날짜
- 수출자, 제조업자 이름, 제조국
- 제품명- 국제일반명(International Non Proprietary name)
- 약물 강도(strength of drug)
- 활성원료 1개 이상인 경우 각각의 원료명과 강도
- 원료의 약전(Pharmacopeia specification)
- TFDA제품 등록번호
- 수입 제품 수량, 단가, 총금액, 화폐단위
- 제품별 배치번호
- 제조일자, 유통기한
- 운송 수단(배, 비행기, 육로)
- 수출항과 도착항
- 도착 예정일
- 수출자의 서명(Signature) 및 도장ㅇ 수입품 라벨링 필수 사항
- 상표명(trade or brand name)
- 국제일반명(International Non-Proprietary Name)
- 주어진 API(원료 의약품) 내 원료성분(active ingredients) 개수
- 제조일자와 유통기한
- 배치번호 또는 제품번호(Batch or Lot number)
- 보관방법
- 제조업자의 이름, 주소
- TFDA로부터 발급받은 제품 등록번호(포장재 안, 밖 표기)
- 원료의약품 설명서(API specification)
- 라벨의 정보는 1차 또는 2차 용기에 새겨져 불변하도록 기록돼야 함.
- 겉포장재 라벨 및 내용 표기 언어: 스와힐리어, 영어 또는 병기
ㅇ 수입 시 기타 주의사항
- 모든 수입절차는 TFDA 또는 관련 정부기관으로부터 적법하게 등록된 관련시설 소유 수입자에 한함.
- 기부 의약품의 경우 수입자는 '기부증서(donation certificate)'를 제출해야 하고 기부 의약품은 좋은 품질, 안전하고 동물 섭취에 적합해야 하며 제조국에서 금지된 품목이 아닌 경우
- 수입제품 유통기한(shelf life)이 24개월 이상인 제품의 경우 유통기한이 최소 60% 이상 남아있어야 하며 유통기한이 24개월 미만인 제품은 유통기한의 80% 이상이 남아있어야 함.
ㅇ 수입 특별 케이스 분류
- 기본적으로 기본 수입절차를 따르나 분류에 따라 추가 요구사항을 만족할 경우 수입 허가
주: controlled drug은 마약, 향정신성의약원료(psychotropic substance) 또는 전구물질(precursor) 성분 포함 의약품① 미등록 의약품의 수입
- 신청자가 어떠한 이유에서 미등록 의약품에 대해 특별허가(special permit)를 신청한 경우
- 탄자니아 내 해당 대체 의약품(Therapeutic alternative products)이 존재하지 않는 경우
- TFDA에서 인증한 의약품제조품질관리기준(Good Manufacturing Practice: GMP) 시설에서 생산된 의약품의 경우
- 대체 의약품이 존재하지만 최소 6개월 이상 탄자니아 내 수입 이력이 없는 의약품의 경우
② 개인적 사용 목적의 의약품 수입
- 개인적 사용 목적의 의약품 수입 허가 신청 시 기등록된 전문의, 치과의사, 수의사 또는 공인된 전문가로부터의 처방전이 필요
- 처방전 이외에도 신청자는 의약품 수입 이유에 대한 별도의 레터 제출 필요
③ 연구용 의약품 수입
- 탄자니아내 승인된 연구의 주요연구자(Principal investigator) 또는 임상실험 후원자(clinical trial sponsor)의 수입허가 신청
- 수입 허가 신청서와 함께 TFDA로부터 발급된 임상실험 승인 레터 제출 필요④ 통제(controlled)의약품* 수입
- 통제 의약품 수입의 경우, 6개월간 유효한 통제의약품 수입증명서(controlled drugs import certificate) 필요
- 통제 의약품 수입 증명서는 TFDA 본사에서 처리
- 마취성(Narcotic) 의약품은 MSD(Medical Stores Department)를 통해서만 수입 가능
⑤ 의약품 무료 샘플 수입
- 무료 의약품 샘플 수입은 아래 기준을 따라야 함.
- 기준 만족 시 수입 허가 비용은 별도로 부과되지 않지만 미준수시 FOB 비용(2%) 부과됨.
· 샘플 제품의 라벨은 'Free sample- Not for sale' 문구를 포함
· 샘플은 일반 상품 보다 작은 크기의 용기에 포장
· 제품의 개수(unit pack)는 300개 미만· 무료 제공(Free of Charge Goods) 의약품 수입
- 수입 허가 비용(FOB의 2%)은 일반적 수입 경우와 같음.
- 상업 송장에 각 제품의 단위가격을 명시⑥ 기타 의약품의 수입
- 1.2, 1.3에 제시된 요구 사항에 더불어, 아래 범주에 속하는 경우 신청자는 레터 제출 필요
· 긴급상황에 필요한 의약품(ex. 전염병, 자연재해, 사고 등)
· 암과 같은 특정 질병 치료 목적의 의약품
· 소외질환(Neglected diseases) 치료 목적의 의약품(병명 예시: Leshmaniasis, Telariasis, Filariasis, Onchoriasis, and Elephantiasis)
ㅇ 수입항 도착 후 검사 절차
① 수입항 도착 후 TFDA 조사관에 의해 의약품 검사 실시
② 수입항에서 필요 서류- 묶음(batch)별 수입 허가서(Import Permit)
- 상업 송장 원본
- 분석 증명서(Certificate of analysis)
- 항공 화물 운송장(airway bill) 또는 선하증권(bill of lading)
- 통제 의약품(controlled drugs)의 경우 별도의 수입증명서(certificate for importation of psychotropic/narcotic drugs)
③ 수입항에서 검사자는 추가 검사 목적으로 의약품 견본 검사(샘플링)를 요구할 수 있음.
- 샘플링 진행 과정
· 필요 시 샘플링 절차 수행
· 샘플링 양식(sample collection form) 작성
· 샘플링 절차, 특히 실험실 분석일 경우 보통 2주이상 소요, 결과가 나올 때 까지 인가된 점포(premises)에 상품 조건부 보관 가능
· 샘플링 이후에 제품은 수입이 허가되거나 추가 조사가 요구될 수 있으며 수입 불허도 가능
ㅇ 수입항 검사시 제품의 허가 또는 불허가 조건
① 허가조건(Conditions for release of consignments)
- 모든 수입 조건 만족시 수입 승인
- 승인 시 조사관은 제출된 모든 서류에 'APPROVED FOR RELEASE' 도장을 찍어 허가 표기
- 분할 선적의 경우 2회에 한해 적용되는 수입 허가가 발급되며 원본 상업 송장과 수입허가 서류에는 'Partial Shipment' 라고 표기되고 현재 수입 수량 및 나머지 수입 예정 수량도 표기됨.
② 불허가조건(Conditions for rejection)
- 수입 요구사항 불만족시 'STOP RELEASE' 표기와 함께 수입항에서 수입이 불허됨.
- 수입항에서 제품 불허시, 조사원이 가이드라인에 따라 의약품 불허,억류 양식 (Rejection/Detain Form) 제공
- 미승인 케이스 분류i) 품질상의 이유로 미승인된 경우: 폐기처리됨(condemned)
- 제품의 폐기는 세관의 필수사항(Customs requirements)에 따라 진행됨
- TFDA가 부적절한 의약품 처리 가이드라인(guidelines of disposal of unfit pharmaceutical products)에 따라 폐기 방법(mode of destruction)에 대한 기술 자문 제공
- TFDA는 부적절한 제품에 대한 폐기절차 수행 완료 후 폐기인증서(Destruction Certificate) 발급
ii) 탄자니아 내 미등록 상품이거나 라벨링 조건 불만족으로 미승인된 경우: 요청 시 제3의 국가로 재수출(re-exported to a third country) 될 수 있음.
- 재수출의 경우 수출허가신청 이전에 제품 재검사가 선행돼야 함.
- 재수출품 선적시 세관원 및 TFDA의 의약품 조사원 검사 필요
- 수출 후 수출항에서 도장이 찍힌 재수출 관련 서류는 TFDA에 증빙 자료로 제출 필요
ㅇ 동물용 의약품 수입 관련 비용
번호
내용
단위
비용
1
Permit for Pharmaceutical importer
TZS
300,000
2
Importation of donated medicines
FOB
0.5%
3
Permit for importation of medicines(finished product)
FOB
2.0%
4
Permit for importation of pharmaceutical raw materials
(active pharmaceutical ingredients)FOB
0.5%
자료원: Tanzania Food, Drugs and Cosmetics(Fees and Charges) Regulations, 2015
ㅇ 의약품 제조품질 관리기준(Good Manufacturing Practice: GMP) 검사 비용
번호
내용
화폐단위
비용
국내 GMP 검사 비용(per block)
1
국내 의약품 GMP 검사비용
USD
250
외국 식품, 의약품, 의료기기 생산시설 GMP 검사 비용(per block)
2
East Africa
USD
4,000
3
Rest of Africa
USD
5,000
4
Asia
USD
6,000
5
Europe
USD
7,000
6
America
USD
8,000
자료원: Tanzania Food, Drugs and Cosmetics(Fees and Charges) Regulations, 2015
□ TFDA 동물용의약품 등록내역(제조국 South Korea 기준)
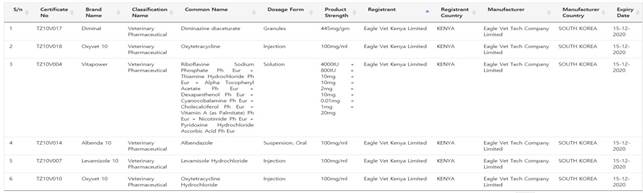
자료원: TFDA Registered products
□ 시사점
ㅇ 탄자니아 정부는 병아리와 닭고기 수입금지 조치를 단행해 현지 투자진출 호기로 작용
- 동물 관련 질병 통제 및 자국시장 보호가 주요 목적
- 탄자니아 정부는 자국의 산업화 및 산업보호를 위한 각종 수입금지 조치를 진행하고 있음(예: 석탄 수입금지 등).
ㅇ 킬리만자로지역 및 바가모요지역에 양계업 외국인투자가 진행 중
- 기존 수입에 의존했던 닭고기 수요 충당이 목적(주요 수입국: 브라질)
- 현지 양계업 및 축산업 투자는 필연적으로 동물질병 예방에 대한 관심 및 수요 점증 예상
자료원: TFDA, 국제공통기술문서(CTD) 가이드라인, TRA, KOTRA 다레살람 무역관 자료 종합
<저작권자 : ⓒ KOTRA & KOTRA 해외시장뉴스>

KOTRA의 저작물인 (탄자니아 동물용 의약품 등록 및 수입절차)의 경우 ‘공공누리 제4 유형: 출처표시+상업적 이용금지+변경금지’ 조건에 따라 이용할 수 있습니다. 다만, 사진, 이미지의 경우 제3자에게 저작권이 있으므로 사용할 수 없습니다.
-
1
말레이시아 핀테크 시장현황
말레이시아 2018-01-18
-
2
베네수엘라 용접봉 수출기회 높아
베네수엘라 2018-01-17
-
3
수출길 열린 아르헨티나 배(pear)시장
아르헨티나 2018-01-18
-
4
싱가포르 전력시장 2018년 내 전면 자유화
싱가포르 2018-01-17
-
5
스리랑카 사료첨가제 시장동향
스리랑카 2018-12-31
-
6
파라과이 장난감 시장동향
파라과이 2018-01-18
-
1
2021년 탄자니아 산업 개관
탄자니아 2021-09-13
-
2
2021년 탄자니아 인프라 건설 산업 정보
탄자니아 2021-09-13
-
3
2021년 탄자니아 이동통신산업 정보
탄자니아 2021-09-13
-
4
2021년 탄자니아 광물산업 정보
탄자니아 2021-09-13
-
5
2021년 탄자니아 농업 정보
탄자니아 2021-09-13
-
6
탄자니아 인프라 건설 산업 정보
탄자니아 2020-11-23
- 이전글
- 다음글













