-
인도의 체외진단 시장 동향과 우리 기업의 진출 전략
- 트렌드
- 인도
- 뭄바이무역관 이준호
- 2024-08-28
- 출처 : KOTRA
-
경쟁력 갖춘 글로벌 체외 진단 기기 기업의 진출 기회 다대
인도 진출 전 중앙면허관리국(CDSCO)의 규제 사항 잘 살펴야
인도의 의료기기 시장 특성
1990년대 초 까지만 해도 인도의 의료기기 시장은 자국 업체가 대부분이었다. 그러나 1991년 인도가 의료기기 시장을 개방한 이후 국제 의료기기 기업들이 제공하는 기술과 전문 지식으로 인해 시장은 빠른 속도로 다변화되었다. 덕분에 오늘날 인도 의료기기 시장은 다국적 기업이 장악하고 있으며, 의료기기 판매 매출의 약 80%가 수입산 제품으로부터 발생하고 있다.
인도 의료기기 시장은 크게 전자 의료장비, 수술용 기구, 임플란트, 체외 진단 기기(IVD), 소모품 및 일회용품의 총 5개 카테고리로 나눌 수 있다. 인도의 의료기기 시장은 수입 의존도가 높은 편이며, 고급 기술력을 갖춘 장비일수록 의존도는 더욱 높아지는 추세를 보인다. 때문에 인도 내에서 제조되는 의료기기들은 주로 대량생산이 가능한 저가의 소모품들이 주를 이룬다.
<인도 의료기기 수입(좌)/수출(우) 중 제품 카테고리별 점유율>
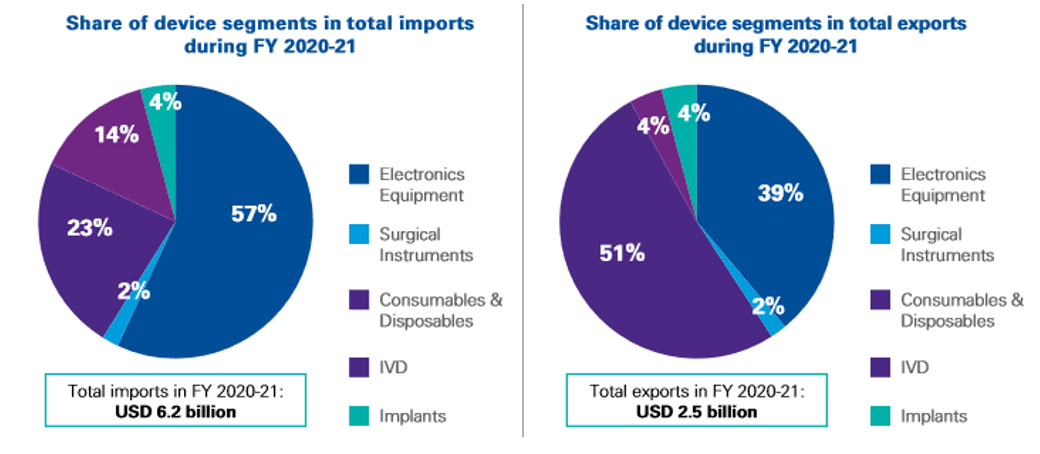
[자료: KPMG]
인도 의료기기 시장의 평균 투자액은 약 250만 달러 수준이며, 평균 매출액은 약 650만 달러에 이른다. 이 시장은 800개 이상의 제조업체들로 구성되었으며, 고도로 세분화되어 있다. 또한 인도 전체 의료기기 시장에서 활동하는 제조업체 중 약 65%는 자국 업체이다. 그러나 시장의 상당 부분은 전자 장비, 수술 장비 및 환자 지원과 같은 고급 장비를 공급하는 다국적 기업이 장악하고 있다.
<인도의 주요 의료기기 제조 지역>
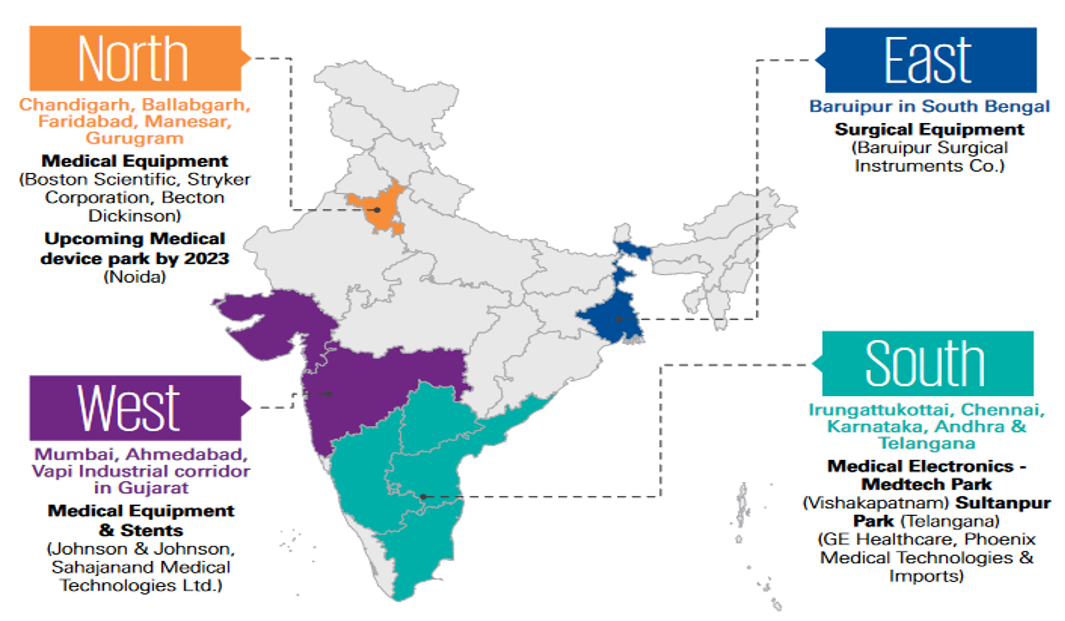
[자료: KPMG]
인도 체외 진단(IVD) 시장 분석
Mordor Intelligence에 따르면 인도 체외 진단(IVD) 시장 규모는 2024년 기준 약 17억 달러 규모로 추정되며 연평균 6.58%씩 성장하여 2029년이면 약 23억 달러 규모에 이를 것으로 예상된다. 인도 체외 진단 시장의 성장을 이끄는 주요 요인으로는 만성 질환의 높은 유병률, POC(point-of-care) 진료 기법의 사용 증가, 맞춤형 의료 서비스의 발달 등이 있다.
<인도 체외 진단(IVD) 시장 규모 변화 추이(2024~2029년)>
(단위: US$ 10억)
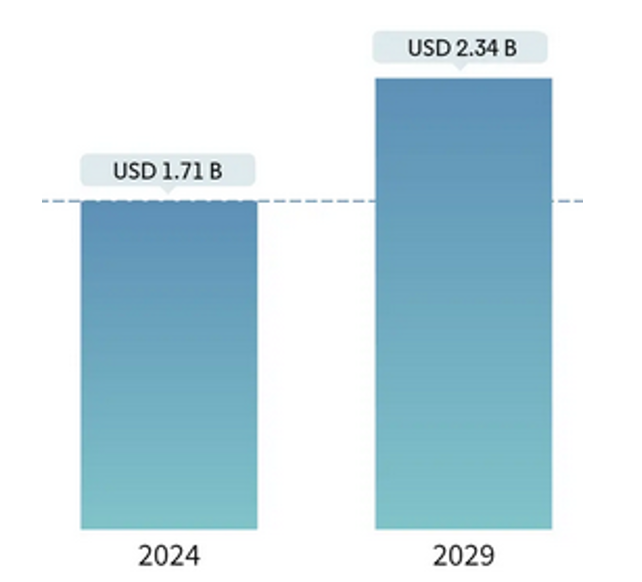
[자료: Mordor Intelligence]
인도의학연구위원회(ICMR)의 2021년 보고서에 따르면 인도의 암 환자 수는 2021년의 2,670만 명에서 2025년이면 2,980만 명으로 증가할 것으로 예상된다. 암에 대한 부담이 증가함에 따라 보다 효과적이고 시기 적절한 치료를 위해 암 조기 진단의 필요성이 높아지고 있으며, 이에 따라 체외 진단에 대한 수요도 함께 증가하고 있다. 덕분에 체외진단 시장에서는 앞으로 많은 수요가 발생할 것으로 전망된다.
국제당뇨연맹(IDF)에서도 비슷한 통계를 발표했는데, 2022년에 인도에서 약 7,410만 명이 당뇨병을 앓았으며, 2030년이면 약 9,290만 명, 2045년이면 1억 2,480만명까지 그 수가 증가할 것으로 전망하고 있다. 인도에서 당뇨병 환자들의 수가 증가할 것으로 예상됨에 따라 혈당을 측정하기 위한 체외 진단 기기에 대한 수요가 함께 확대될 것으로 보인다.
한편, 바이오센서, 랩온어칩(lab-on-a-chip), 웨어러블 장치 및 POC(point-of-care) 진단과 같은 의료 분야의 기술 혁신은 체외진단 시장에서 점점 더 중요한 요소가 되고 있는데, 예를 들어 POC 검사는 환자에게 더 가까이 다가가 검사를 실시하고 의료 서비스 제공자가 진단 및 후속 치료를 신속하게 처리할 수 있도록 도움을 준다. 이와 같은 의료 기술의 발전은 체외진단 시장의 성장에 긍정적인 영향을 미칠 것으로 보인다.
<인도의 체외진단 시장 세분화>
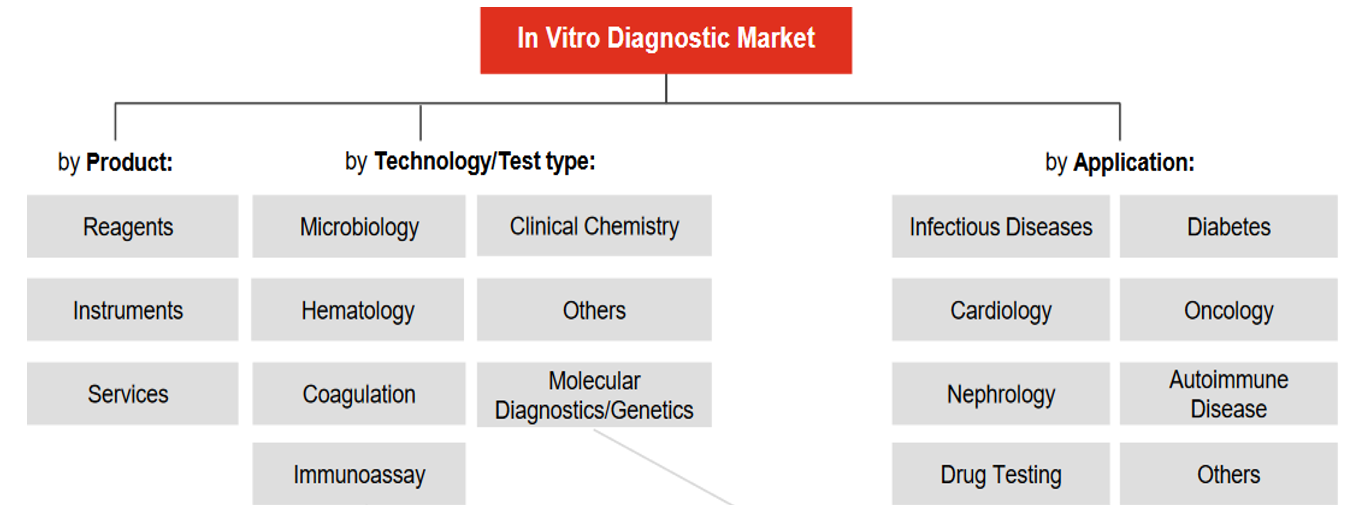
[자료: PwC Analysis]
체외 진단 분야 중에서도 특히 ‘분자 진단(molecular diagnostics)’ 부문은 대규모 전염병의 발생, 현장 진단에 대한 수요 증가, 빠르게 발전하는 기술과 같은 요인으로 인해 인도에서 장기적으로 상당한 성장을 겪을 것으로 예상된다. 코로나19를 겪으면서 인도에서는 분자 진단 시장이 상당한 성장을 이룩하였다. 인도 분자 진단 시장 규모는 2022년 기준 약 9억 5000만 달러 수준이며, 연평균 7%씩 성장해 2030년이면 16억 달러 규모에 이를 것으로 전망된다.
<연도별 인도 분자 진단 시장 규모>
(단위: US$ 10억)
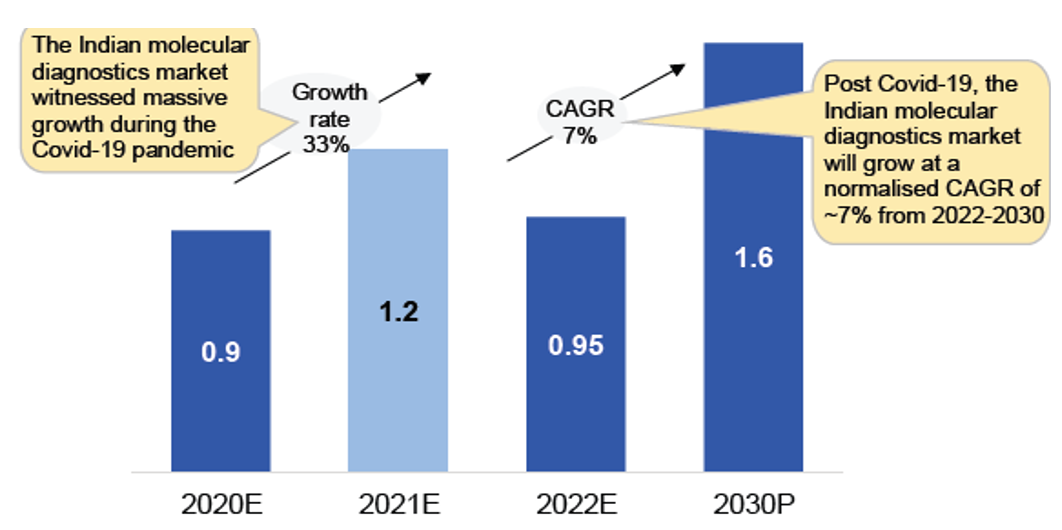
[자료: 1Lattice analysis]
분자 진단의 응용 분야로는 종양학 및 감염성 질환 등이 있으며, 암에 대한 예측 검사를 수행하거나, COVID-19, 뎅기열, 말라리아, 결핵, 인플루엔자, HIV 및 간염과 같은 전염병에 대한 신뢰할 수 있는 진단을 제공한다.
현재 전세계 분자 진단 시장은 Roche 및 Abbott과 같은 다국적 기업이 지배하고 있으며, 인도에서는 Molbio, Mylab 및 TATA MD와 같은 인도 기업들이 시장에서 입지를 굳히기 위해 노력하고 있다. 또한 인도의 일부 스타트업은 최근 몇 년 동안 전 세계로부터 투자를 유치하기도 했다.
<인도 분자진단 시장의 다양한 기업들>
다국적 기업
인도 기업


[자료: 1Lattice analysis]
인도 정부의 체외 진단(IVD) 관련 인증 및 규제
인도 보건가족복지부(Ministry of Health & Family Welfare) 예하 중앙 면허 관리국(Central Licensing Authority), 즉 CDSCO는 1945년 ‘의약품 및 화장품법’ 및 ‘2017년 의료기기 규칙’ 등에 따라 체외진단 키트, 시약 및 의료기기의 수입, 제조, 판매 및 유통을 관리하는 전체 규제 프레임워크를 개정한 바 있다.
GHTF(Global Harmonization Task Force)의 위험 분류에 따라 인도의 체외 진단 키트는 A, B, C, D등급으로 분류되며, A에서 D로 갈수록 위험도는 증가한다.
인도에서 의료기기를 판매하기 위해서는 반드시 CDSCO에 제품을 등록해야 하는데, 해외 제조업체는 제품 등록을 직접 신청할 수 없다. 합법적으로 의료기기를 인도로 수입하기 위해서는 인도 현지에 기반을 둔 법인을 ‘공인 대리인’ 또는 ‘면허 보유자’로 지정해야만 한다. 결론적으로 제품을 CDSCO에 등록하기 위해서는, 위임장(Power of Attorney)을 통해 임명된 공인 대리인이 MD-14 수입 허가 신청서를 CDSCO에 제출해야 한다.
만약 체외 진단기기의 수입업자 또는 제조업체가 교육, 시연, 임상 조사 목적 또는 테스트를 목적으로 소량의 제품을 수입하려는 경우, 테스트용 수입 면허를 발급 받기 위한 MD-16 양식을 CDSCO에 제출할 수 있다.
<체외 진단기기 수입을 위한 CDSCO 신청 양식 및 수수료>
신청
양식
라이센스 양식
승인기관
소요기간
위험등급
수수료**
MD-14
MD-15
CLA*
약 9개월
A~B
공장: US$ 1,000
제품당: US$ 10
C~D
공장: US$ 3,000
제품당: US$ 500
* CDSCO의 중앙 라이센스 기관
** 변동 가능
[자료: CDSCO, NK Consultant]
<체외 진단기기 수입 관련 자주 묻는 질문과 답변>
질문
답변
체외 진단기기 및 시약을 인도로 수입하기 위한 면허 부여를 신청할 수 있는 사람은 누구 입니까?
MDR 2017규칙에 따라 발행된 제조 면허 또는 도매 면허를 소지한 공인 대리인은 CLA(Central Licensing Authority)에 체외 진단기기에 대한 수입 허가 신청서를 제출할 수 있습니다.
여러 인도 대리인이 동일한 제품에 대해 수입 허가를 신청할 수 있습니까?
예. 모든 신청자는 MDR 2017 규칙에 따라 별도의 신청서를 제출해야 합니다.
MDR 2017 규칙에 따라 발급된 수입 허가증 또는 체외 진단기기 제조 허가증의 유효기간은 어떻게 됩니까?
MDR 2017 규칙에 따라 발급된 수입 허가증 또는 체외 진단기기 제조 허가증은 중단 또는 취소될 때까지 영구적으로 유효합니다. 단 매 5년마다 라이센스 유지 비용을 납부해야 합니다.
수입 면허 발급 후 인도 대리인/수입업자의 이름 및/또는 주소 변경 또는 정관 변경이 있는 경우 라이센스 기관에 알려야 합니까?
예. 인도 공인 대리인은 해외 제조업체 또는 공인 대리인의 정관에 변경이 있는 경우 45일 이내에 서면으로 CLA에 이러한 변경 사항을 알려야 합니다.
수입 면허 발급 후 실제 제조업체의 이름 및/또는 주소가 변경된 경우 라이센스 기관에 알려야 합니까?
예. 인도의 라이센스 사용권자 또는 권한을 부여 받은 대리인은 실제 제조업체의 이름 또는 주소가 변경되는 경우 라이센스 당국의 사전 승인을 받아야 합니다.
수입업자가 유효한 수입 면허를 소지하고 있지만, 수입업자의 이름이나 주소가 약간 변경된 경우, 다른 수입 허가가 부여되기 전까지 수입을 지속할 수 있습니까?
아니오.
인도에서 체외 진단기기에 부착되는 라벨이 갖추어야 할 사항은 무엇입니까?
제품 라벨은 2017년 의료기기 규정(Medical Device Rules) 6장의 요구 사항을 준수해야 합니다.
인도에서 금지된 체외 진단기기 시약/키트는 무엇입니까?
결핵 진단을 위한 혈청 진단 검사 키트 및 말라리아의 정기 진단을 위한 항체 검출 신속 진단 검사 등이 있습니다.
체외 진단기기의 수입 및 제조와 관련된 문의는 어디에 할 수 있습니까?
Drugs Controller General India
CDSCO, FDA Bhawan, ITO, Kotla Road, New Delhi - 110002.
Email: dci@nic.in
Phone: 91-11-23236965 / 23236975.
[자료: CDSCO]
시사점과 기회
한국의 체외 진단기기 제조업체가 인도 시장에 진출하기 위해서는 몇 가지 전략적 단계를 거쳐야 한다. 첫째, 현지 인도 기업과 전략적 파트너십 또는 합작 투자이다. 이를 통해 중요한 시장 통찰력, 기존 유통 네트워크에 대한 액세스 및 규제 환경에 대한 이해를 제공받을 수 있다. 또한 현지 기업과의 협력은 인도 시장에서 외국산 제품에 대한 신뢰성과 수용도를 높일 수 있을 것이다. 둘째, 틈새 시장과 특화된 제품에 집중하면 차별화하는 데 도움이 될 수 있다. 첨단 분자 진단 또는 혁신적인 POC 테스트 장치와 같은 제품을 공급함으로써 한국 기업은 인도 의료 부문의 충족되지 않은 특정 요구 사항을 만족시킬 수 있다.
현지 제조 및 연구 개발(R&D)에 대한 투자도 외국 수출업체에게는 전략적 움직임이 될 수 있다. 현지 R&D 센터는 인도 시장에 맞춘 제품 맞춤화와 혁신을 가능하게 하여 한국 제품의 경쟁력을 높일 수 있다. 또한 인도에 생산 시설을 구축하면 비용을 절감하고 공급망 효율을 개선하며 인도 정부에서 제조업 유치를 위해 펼치고 있는 Make in India 정책을 통해 혜택을 받을 수도 있다.
그러나, 무엇보다도 규제사항에 대해 파악하고 있는 것이 시장 진출 시 매우 중요하다. 경험이 풍부한 컨설턴트 또는 현지 파트너와 협력하여 CDSCO 규정을 준수하고, 필요한 라이센스를 획득하고, 변동 사항을 항상 최신 상태로 유지해야 할 것이다.
Vishat Diagnostic 사의 Pratik은 KOTRA 뭄바이무역관과의 인터뷰를 통해 다음과 같이 말했다. "인도 시장에 진출하는 외국 의료기기 제조업체의 경우 CDSCO(Central Drugs Standard Control Organization) 규정 준수를 포함한 규제 환경에 대해 이해하는 것이 중요합니다. 상품이 인도 표준에 따라 등록 및 승인되었는지 확인하세요. 현지 유통업체 또는 대리점과 파트너 관계를 맺으면 시장 및 규제 프로세스를 효과적으로 탐색하는 데 도움이 될 수 있습니다. 또한 현지 시장의 요구 사항을 이해하고 그에 따라 마케팅 전략을 조정하는 것도 중요합니다. 제품 포장과 설명서를 현지화하는 것 또한 잊지 말아야 합니다."
자료: KPMG, Mordor Intelligence, PwC Analysis, 1Lattice, CDSCO, KOTRA 뭄바이무역관 보유 자료 종합
<저작권자 : ⓒ KOTRA & KOTRA 해외시장뉴스>

KOTRA의 저작물인 (인도의 체외진단 시장 동향과 우리 기업의 진출 전략)의 경우 ‘공공누리 제4 유형: 출처표시+상업적 이용금지+변경금지’ 조건에 따라 이용할 수 있습니다. 다만, 사진, 이미지의 경우 제3자에게 저작권이 있으므로 사용할 수 없습니다.
-
1
2021년 호주 의료기기 산업 정보
호주 2021-12-27
-
2
호주 색조 화장품 시장동향
호주 2024-08-28
-
3
인도 측정 검사용 장비 시장 동향
인도 2024-08-29
-
4
중국 ICT 기업 요람 선전시, ‘산업용 로봇 산업 중심지’로 떠올라
중국 2024-08-28
-
5
싱가포르, '제로' 향한 건강 라이프스타일
싱가포르 2024-08-28
-
6
성장하는 인도 전기 자동차 시장, 소형 e-모빌리티 산업의 가능성을 알아보자
인도 2024-08-28
-
1
2024년 인도 해양 산업 정보
인도 2024-07-09
-
2
2023년 인도 전기자동차 산업 정보와 현지 동향
인도 2023-12-12
-
3
2022년 인도 반도체산업 정보
인도 2022-10-20
-
4
2022 인도 완구산업 정보
인도 2022-08-05
-
5
2022년 인도 화장품 산업 정보
인도 2022-05-25
-
6
2021년 인도 철강산업 정보
인도 2022-01-20













