-
돌파 기점을 맞은 美 재생의료산업, 2024년에도 성장 전망
- 트렌드
- 미국
- 로스앤젤레스무역관 최예은
- 2024-05-09
- 출처 : KOTRA
-
미 재생의료 시장, 2032년까지 규모 확장 지속될 것으로 전망
작년에 이어 올해 역시 FDA 패스트트랙 힘입어 활발한 연구개발 및 시판 승인 이루어질 것
바이오메디컬 산업의 키 플레이어인 미국의 재생의학 업계에 더 큰 성장으로 갈 수 있는 터닝 포인트가 다가오고 있다. 재생의료란 부상이나 질병으로 손상된 인체 조직이나 장기, 세포가 정상적인 기능을 할 수 있도록 회복을 돕는 기술 및 약물, 의료기기 총체를 말한다. 제품 개발에 대한 신속허가 절차를 지원하는 패스트트랙 제도 활성화로 2023년 큰 성장을 보였던 미국의 재생의료 시장은 향후 꾸준한 규모 확장 추세를 이어갈 것으로 예상된다.
미국 재생의료 산업 동향
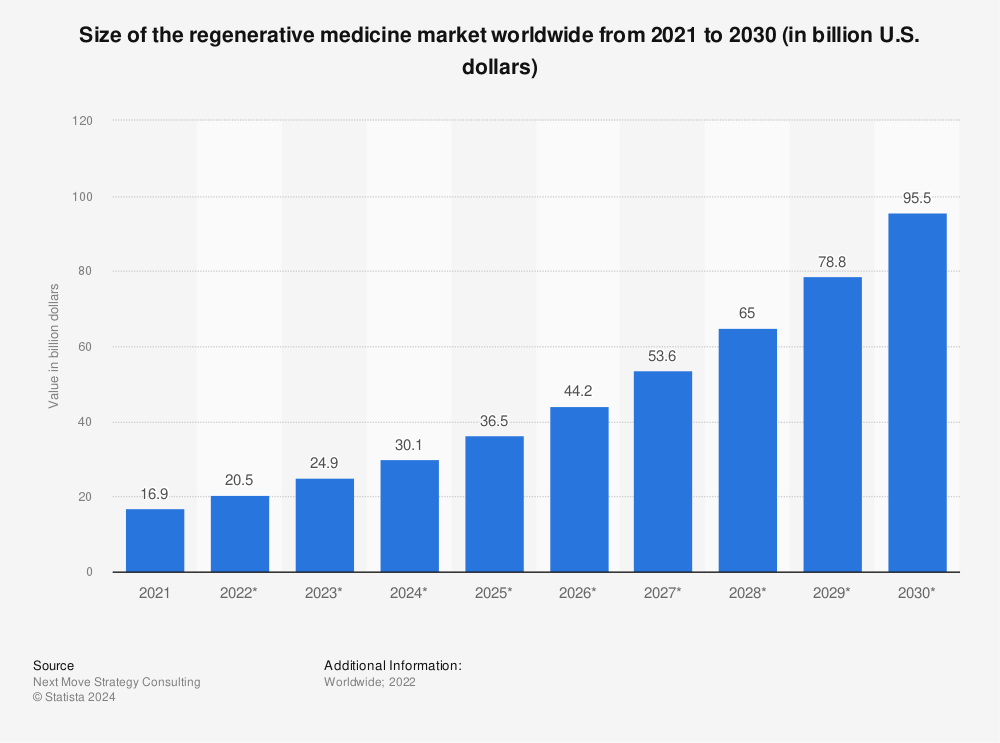
시장조사기관 Statista는 2021년 169억 달러 규모를 기록한 재생의료 시장은 이후 꾸준한 성장을 보여 2030년엔 955억 달러 규모까지 성장할 것으로 전망했다. 희귀 질병 및 부상 치료 기법 개발과 세계 인구 고령화에 따른 세포 및 유전자 치료기술 수요의 증가가 이러한 성장을 뒷받침할 것으로 분석된다.
<전 세계 재생의료 시장 규모 전망(2021~2030)>
(단위: US$ 십억)
[자료: Statista, Distribution of regenerative medicine companies by world region as of 2023(2023.2.)]
전 세계 재생의료 기업의 대륙별 분포를 살펴보면, 북미 지역은 재생의료 기업의 약 47%가 소재해 세계 시장 점유율 1위를 달리고 있으며, 그다음으로 34%의 기업 비중을 차지한 아시아가 2위를 점했다. 재생의료 옹호기관인 재생의료연합(Alliance for Regenerative Medicine)의 2024년 1월 발표 자료에 따르면, 2023년 기준 전 세계에서 진행 중인 재생의학 신제품 임상시험 총 1894건 중 약 52%에 해당하는 972건이 북미 지역에서 이뤄졌다. 또한, 재생의료 분야 투자 금액은 총 117억 달러 중 약 69%에 달하는 81억 달러가 북미 지역에 유치됐다.
<세계 재생의료 분야 기업 분포 현황(2023)>
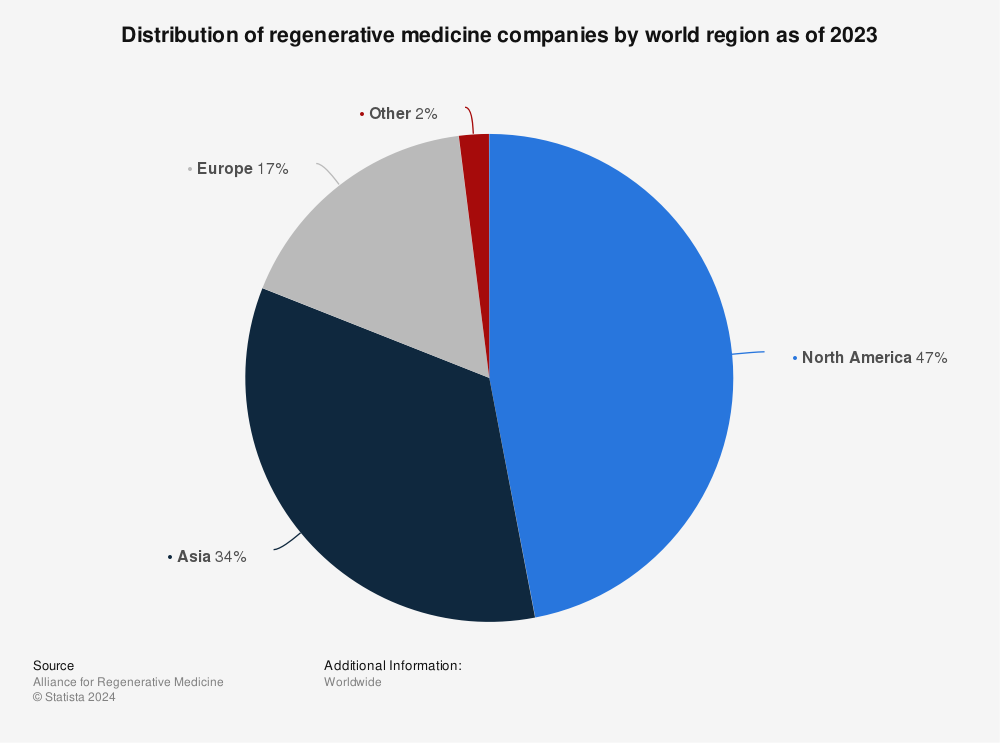
[자료: Statista, Distribution of regenerative medicine companies by world region as of 2023(2023.2.)]
재생의료 분야는 생물학, 의학, 화학 및 공학 등 다양한 분야의 통합적인 연구가 필요해 생명공학 기업들이 주로 연구하고 개발해 성장한다. 미국 내 생명공학 업계 주요 기업으로는 일리노이주 시카고 소재 AbbVie, 캘리포니아주 사우전드오크스(Thousand Oaks) 소재 Amgen, 샌프란시스코 소재 Genentech 등이 꼽힌다. 기업 소재지 분포로는 캘리포니아주가 17%로 가장 높은 분포를 보이는 것으로 나타났다.
<미국 생명공학 기업 시장 점유율 순위(2023)>
(단위: US$ 백만, %)
기업명
소재지(도시, 주)
매출액
시장점유율
AbbVie Inc.
Chicago, IL
41,833
22.9
Amgen Inc.
Thousand Oaks, CA
19,806
10.8
Genentech Inc.
San Francisco, CA
19,501
10.6
Bayer Corp.
Pittsburgh, PA
12,250
6.7
Gilead Sciences, Inc.
Santa Monica, CA
7,088
3.9
[자료: IBIS World, 'Biotechnology in the US’(2024.2.)]
미국 재생의료 정책 및 규제 동향
미국에서 판매 및 유통되는 의료제품은 미 보건복지부 산하 식품의약처(U.S. Food and Drug Administration, FDA)의 관리규제를 받는다. 재생의료제품에 대한 규제는 주로 생물의약품평가연구센터(Center for Biologics Evaluation and Research, CBER) 또는 의료기기 및 방사능 건강 센터(Center for Devices and Radiological Health, CDRH)에서 주관한다. 다만 특정 요건을 충족하는 재생의학 의약품의 경우 ‘연방 식품, 의약품 및 화장품법’(Federal Food, Drug, and Cosmetic Act)에 의거, 첨단재생의학치료제 (Regenerative Medicine Advanced Therapy, RMAT) 지정을 받음으로써 신속개발 및 승인 심사 간소화 또는 단축의 혜택을 누릴 수 있다.
RMAT 지정 심사 신청은 FDA의 생물학적 제재 평가 및 연구센터(CBER)에서 받고 있으며, 지정 기준은 다음과 같다:
ㅇ 세포 치료, 치료용 조직공학 제품, 인간 세포 및 조직으로써 재생의학치료제로 정의되는 것; 연방 공중보건법 Section 361과 연방규정집 Part 1271에 의해 직접 규제되는 대상 제외(The drug is a regenerative medicine therapy, which is defined as a cell therapy, therapeutic tissue engineering product, human cell and tissue product, or any combination product using such therapies or products, except for those regulated solely under Section 361 of the Public Health Service Act and part 1271 of Title 21, Code of Federal Regulations)
ㅇ 생명을 위협하는 질병이나 상태를 치료 또는 완화하기 위한 것(The drug is intended to treat, modify, reverse, or cure a serious of life-threatening disease or condition)
ㅇ 명백한 임상 증거를 통해 상기 질병이나 상태에 대한 (현재까지 충족되지 않은) 의학적 수요를 충족할 가능성이 있음이 증명된 것(Preliminary clinical evidence indicates that the drug has the potential to address unmet medical needs for such disease or condition)
한편, FDA는 2023년에만 5건 이상의 유전자 치료 활용 희귀질병 치료제품을 시판 승인했으며, 세포 치료를 포함하면 총 7건의 승인 사례가 보고됐다. 사례로 7월에는 샌디에이고 소재 Poseida Therapeutics의 동종 T세포 치료요법(allogeneic T-cell therapy) 활용 제품이 신약 승인을 취득해 해당 기법으로서는 미국 최초 FDA 승인 사례로 인정됐다. 12월에는 보스톤 소재 Vertex Pharmaceuticals와 스위스 CRISPR Therapeutics가 합작해 개발한 낫형 적혈구 빈혈증 치료기법인 ‘Casgevy’가 인체 대상 유전자 편집 활용 치료기술 최초로 시판 승인을 취득했다. 같은 질병 치료 목적으로 일반 유전자 치료기술을 활용하는 매사추세츠 소머빌(Somerville) 소재 Bluebird Bio사의 ‘Lyfgenia’ 제품 역시 함께 승인됐다.
<2023년 재생의료 부문 주요 FDA 시판허가 현황>
기업명
기업로고
FDA 시판허가 승인 기술 및 제품
Poseida Therapeutics

P-MUC1C-ALLO1: 동종 T세포(Allogeneic CAR-T-cell) 치료요법
Vertex Pharmaceuticals & CRISPR Therapeutics


Casgevy: 인체 대상 유전자 편집(CRISPR) 치료기술

Bluebird Bio

Lyfgenia: 인체 대상 일반 유전자 치료기술

[자료: 각 사 웹사이트(Poseida Therapeutics, Vertex Pharmaceuticals, CRISPR Therapeutics, Bluebird Bio)]
미 FDA의 잇따른 시판 승인을 두고 세계 재생의료연합은 2023년을 재생의학업계의 혁신적인 전환점으로 평가하며, 2024년에 서구권에서만 17건의 신규 승인 사례가 발생할 것이라는 전망과 함께 향후 산업 활성화에 대한 기대감을 표했다.
미국 재생의료 자재 수출입 동향
재생의학 치료에 쓰이는 장기요법용 인체/동물 물질(장기요법용 선과 그 밖의 기관 – 이식용 피부와 뼈 Glands and other organs for organo-therapeutic uses - skin and bone grafts, HS 3001.90)의 미국 수출입 동향을 살펴본다.
미국의 신체이식용 피부 및 뼈의 2023년 총수입액은 약 4억1400만 달러로 전년 대비 0.25% 소폭 감소했다. 그중 중국으로부터의 수입액이 약 1억5500만 달러로 전체 수입액의 약 37%를 차지해 가장 그 비중이 높았다. 그다음으로는 독일, 뉴질랜드 등이 주요 수입국으로 자리매김하고 있으며 한국은 전체 수입국 순위에서 인도 다음으로 15위를 차지하고 있다. 한국으로부터의 수입액 비중은 전체의 약 0.92%로 높은 수준은 아니지만 전년 대비 29.74% 증가한 것으로 나타났다.
<미국의 이식용 피부/뼈(HS Code 3001.90) 수입액>
(단위: US$ 천, %)
순위
국명
2021
2022
2023
점유율
증감률
-
전체
397,517
414,620
413,574
100.00
-0.3
1
중국
149,380
172,299
154,991
37.48
-10.1
2
독일
41,562
36,877
46,266
11.19
25.5
3
뉴질랜드
26,894
28,573
38,594
9.33
22.7
4
싱가포르
43,854
39,226
32,028
7.74
-18.3
5
스페인
39,147
31,651
28,605
6.92
-9.6
14
인도
245
427
5,078
1.23
1,089.0
15
대한민국
1,827
2,930
3,802
0.92
29.7
[자료: Global Trade Atlas 2024.5.2.]
전망 및 시사점
미국의 주요 수입 파트너 1위 국가인 중국의 대미수출액이 전년 대비 10% 감소한 점 그리고 2022년까지 주요 수입 파트너국 순위에 들지 않았던 인도의 수출액이 전년 대비 약 1089% 가까이 대폭 증가한 점을 고려할 때, 향후 미국의 이식용 자재 수입 파트너국 구성은 아직 활발한 변화가 가능할 것으로 예측된다. 2024년부터 미국 및 전 세계 수요와 신기술 개발에 본격적인 박차가 가해질 것으로 기대되는 만큼, 현지 임상시험 연구기관 네트워킹이나 현지 기업과의 연구개발 협업 방안 모색 등 시장 내 네임 밸류를 형성해 진출 인프라를 구축하는 것이 우선적이겠다.
한편, 규제 환경 변동 역시 주목해야 한다. KOTRA 로스앤젤레스 무역관이 인터뷰한 미국 수입통관 전문가 B는 “시판 승인 없이는 미국 시장 진출 길이 막히는 만큼, 꼼꼼한 규제 동향 모니터링이 여느 때보다 중요한 시점”이라고 밝혔다. 미국 진출을 도모하는 우리 바이오메디컬 기업은 전문 로펌 또는 현지 통관 대행사를 이용해 FDA 시판 허가 취득을 최우선 과제로 삼아야 할 필요가 있겠다.
자료: Food and Drug Administration (FDA.gov), Alliance for Regenerative Medicine, Global Trade Atlas, PR Newswire, Statista, 그 외 KOTRA 로스앤젤레스 무역관 자료 종합
<저작권자 : ⓒ KOTRA & KOTRA 해외시장뉴스>

KOTRA의 저작물인 (돌파 기점을 맞은 美 재생의료산업, 2024년에도 성장 전망)의 경우 ‘공공누리 제4 유형: 출처표시+상업적 이용금지+변경금지’ 조건에 따라 이용할 수 있습니다. 다만, 사진, 이미지의 경우 제3자에게 저작권이 있으므로 사용할 수 없습니다.
-
1
간편하게 건강하게! 일본 고단백 식품 붐
일본 2024-05-21
-
2
캐나다 헤어케어 시장 동향 및 트렌드
캐나다 2024-05-10
-
3
美 뷰티 시장의 새로운 패러다임, '뷰티 테크'로 열다!
미국 2024-05-10
-
4
피부 관리도 윤리적으로 건강하게, 성장하는 미국 비건 뷰티 시장
미국 2024-05-09
-
5
한국 기업이 주목해야 할 헝가리 주류 시장 트렌드
헝가리 2024-05-09
-
6
불황 없이 성장 중인 호주 라면 시장, 지속가능성도 고려 필요
호주 2024-05-10
-
1
2021년 미국 사이버 보안 산업
미국 2022-01-04
-
2
2021년 미국 의류 산업 정보
미국 2022-01-03
-
3
2021년 미국 엔터테인먼트 및 미디어 산업 정보
미국 2021-12-30
-
4
2021년 미국 자동차 산업 정보
미국 2021-12-30
-
5
2021년 미국 석유 및 정유 산업 정보
미국 2021-12-30
-
6
2021년 미국의 반도체 장비 산업 정보
미국 2021-12-30













