-
인도 진출의 관문, 제품 인증에 대해
- 통상·규제
- 인도
- 뉴델리무역관 임성식
- 2017-11-08
- 출처 : KOTRA
-
- BIS, CRS, CDSCO, FSSAI 등 품목별 인증절차와 제도 -
- 2개 기관 이상의 인증을 필요로 하는 품목도 있어... 꼼꼼히 따져야 -
□ 인도 인증제도 현황
ㅇ 품목별 인증제도와 기관 운영
- 인도의 인증제도는 품목별 구분에 따라 이루어지며, 해당 품목에 대한 관할 정부부처, 기관, 법령이 세분화돼 있음.
- 대표적인 인증제도와 품목은 다음과 같음.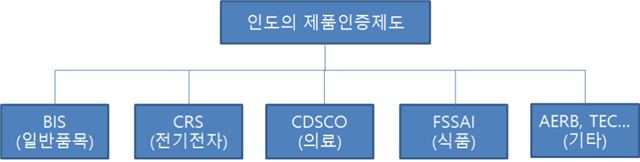
자료원: KOTRA 뉴델리 무역관 직접 작성
ㅇ 일부 제품의 경우, 2개 이상의 인증이 필요
- 1개의 인증만을 필요로 하는 품목이 대부분이나, 일부 품목의 경우 2개 이상의 인증을 받아야 유통이 가능하기 때문에 주의할 필요가 있음.
- 예를 들어, 유아용 식품(Infant Food), 유제품(Milk Product)의 경우 BIS와 FSSAI의 두 개의 인증을 받아야 하며 의료용 X선 장비의 경우 BIS, CDSCO, AERB 인증 모두로부터 허가를 받아야 함.
- 전기전자 제품의 경우 CRS 인증을 받게 돼 있는데, 이 인증작업을 수행하는 기관이 별도로 있지 않고 BIS에서 함께 처리하고 있음.□ 인도 인증제도
1) BIS - 일반품목 및 철강제품

ㅇ 주요 품목: Cement products, Automotive Accessories(Tyres), Cylinder, Valves Regulators, Medical X-ray equipment, Steel and Stainless steel products, Electrical Transformers, Motors and Capacitors, Infant milk and milk foods
ㅇ BIS(Bureau of India Standards)
- 인도 표준국을 말하며 한국의 KS마크와 같이 대부분의 품목에 대한 제품 인증을 심사하고 발행하는 기관임. 1986년 'BIS Act' 법에 의해 창설됐으며, 인도 소비자부(Ministry of Consumer Affairs, Food & Public Distribution) 산하 공공기관임.
- BIS는 ISO(International Organization for Standardization)와 IEC(International Electronical Commission), WSSN(World Standards Service Network) 등 국제 표준관련 단체들과 긴밀하게 협조하고 있으며, 총 112개 품목에 대해 의무 등록 규정을 제시하고 있음.
ㅇ 제품 등록의 절차
- 수입제품에 대한 제품등록은 BIS 내의 Foreign Manufacturers Certification Division(FMCD)이 담당하고 있으며, 부서는 뉴델리의 BIS 본부에 위치해 있음. 수입제품의 등록절차는 2000년 제정된 Foreign Manufacturers Certification Scheme(FMCS)라는 규칙에 의거함.
- 소요기간은 서류 등록 이후 6개월이 걸리는 것으로 공식 제시돼 있으나 실제로는 서류의 보완, 공장 실사 일정 협의, 샘플 제출 등으로 인해 상이함. 최초 인증은 1년간 유효하며, 1년 혹은 2년 단위 갱신이 이루어짐.1단계
서류 준비: 지사·연락사무소 등 판매 주체의 인도 내 사업등록증, 인도 내 대리자 혹은 에이전트(AIR, Authorized Indian Representative) 지정 서류, 상품 제조과정 설명서, 공장내 품질보증 시스템, 부품과 원료관련 인증자료, 제조기계 및 테스트 장비의 리스트, 기타 서류(http://bis.org.in/fmcs/FM_CHECKLIST.pdf)
2단계
인도내 대리자 혹은 에이전트(AIR)의 지정
3단계
서류 제출: 상기 서류와 등록 비용의 접수
· 등록비용: 신청료(1000루피), 실사비용(7000루피/1인 일당), 테스크 비용(실비), 등록갱신료(1000루피/매년)
4단계
BIS서류 접수 및 등록
5단계
제품등록 스케줄 통보 및 BIS 직원의 공장실사 일정 협의
6단계
공장 실사 및 BIS 자체 검사를 위한 샘플 획득
7단계
라이선스 획득 후 제품 보증 채권에 서명
8단계
인증 획득 기업은 분기별로 BIS에 제품등록 준수사항을 보고해야 함
자료원: 인도 BIS 홈페이지
2) CSR – 전기전자제품

ㅇ 주요 품목: Computer, Notebook, Tablet, Electronic games, Music system, Microwave, Printer, POS, Mobile phones, Power Adaptors, Battery, TV, LED lights, CCTV etc.
- 세부 리스트: http://crsbis.in/BIS/products.do
ㅇ CRS(Compulsory Registration Scheme)
- BIS가 지정한 강제등록제도를 의미하며, 전기전자 및 IT제품에 대해서 적용되고 있음. 2012년 10월 3일 발효된 Electronics and Information Technology Goods Order 규칙에 근거하고 있으며, 인도 정보통신부(Ministry of Electronics and Information Technology)의 의뢰를 받아 BIS가 인증절차를 수행하고 있음.
- 전기전자 및 IT 관련 44개 제품이 이 등록제도의 대상 품목임. 컴퓨터, 노트북, 테블릿 PC, 전자오락, 프린터, POS기기, 핸드폰 등임.
ㅇ 제품등록의 절차
- 관련 제품의 등록은 BIS 내의 the Registration Department under Scientist-F라는 부서에서 담당하고 있으며, 실질적인 제품 검사는 BIS가 지정한 인도내 연구소에서 이루어짐. 인도 내 연락사무소나 법인이 없는 외국기업의 제품의 경우 인도 내 대리인(AIR, Authorized Indian Representative)을 지정해야 함.
- 세부적인 절차는 다음과 같으며, 소요기간은 오프라인 서류가 접수된 이후 20일 정도임. 최초 인증은 2년간 유효하며 이후 2년 단위 갱신이 이루어짐.1단계
서류준비 및 제출: 관련 서류(http://crsbis.in/BIS/login.do)를 작성한 뒤 온라인 접수를 하며, 출력된 서류를 온라인 접수 후 15일 내에 BIS에 제출해야 함. 2만8000루피(세금별도)의 비용을 납부해야 함
2단계
BIS서류 접수 및 심사
3단계
제품등록을 완료한 제조사는 인도 표준등록 번호를 부여받으며, 제품에 이를 표기해야 함
자료원: 인도 CRSBIS 홈페이지
3) CDSCO - 의료기기, 의약품, 화장품
ㅇ 주요 품목
- (의료) Disposable Hypodermic Syringes, Needles, Perfusion set, In vitro diagnostic devices, Catheter, IO Lens, IV Cannulae, Bone Cement, Heart Valve, Orthopaedic implants, Ligature, Staplers, Surgical Dressing, Blood component bags
· 세부 리스트: http://www.cdsco.nic.in/writereaddata/list-of-notified-medical-device(1).pdf
- (화장품) Skin care products, Skin cleansing products, Body hair removal, Body hair bleach, Anti-perspiration and Shaving products, Make up, Hair & Scalp products, Nail products, Oral hygiene products.
ㅇ CDSCO(the Central Drugs Standard Control Organization)
- CDSCO는 인도내 제약, 의료기기 관련 규제와 등록제도를 운영하는 정부기관임. 인도 보건복지부(Ministry of Health and Family Welfare) 산하임.
- 인도 내 모든 의약, 의료기기, 화장품의 수입, 제조, 판매, 유통은 Drugs and Cosmetics Act 1940 and Rules 1945 법령을 준수해야 함.
ㅇ 제품등록의 절차
- 수입 의료기기 및 화장품의 제품 등록은 각각 CDSCO 내의 Drugs and Medical Device Division과 Cosmetic Division에서 담당하고 있음.
- 의료기기 기준 세부적인 절차는 다음과 같으며, 소요기간은 서류가 접수된 이후 9개월 정도임. 인증은 3년간 유효함.1단계
서류 준비: form-40 서류, 인도 내 대리자 혹은 에이전트(AIR, Authorized Indian Representative) 증빙서류, 인도 내 상품유통 라이선스 증빙서류
· http://www.cdsco.nic.in/writereaddata/FAQ-IMPORT-&-REGISTRATION-02022013_DONEE.pdf
2단계
서류 제출: 상기 서류와 등록 비용의 접수
· 등록비용: 제조시설 심사등록료(1500달러), 기기 심사등록료(1000달러/기기당), 제조시설 실사료(5000달러)
3단계
CDSCO서류 접수 및 등록
자료원: 인도 CDSCO 홈페이지, KOTRA 뉴델리 무역관 현지 벤더 인터뷰
4) FSSAI - 식품
ㅇ 주요 품목 : Food products, Processed and packed food products, Novel Foods, Health supplements, Nutraceuticals, Food additives
ㅇ FSSAI(the Food Safety and Standard Authority of India)
- FSSAI는 Food Safety and Standard 2006 법령에 의거해 창설된 인도 보건복지부(Ministry of Health and Family Welfare) 산하 정부기관임.
- 인도 내에서 식품의 제조, 보관, 유통, 판매, 수입과 관련해 식품 안전을 위해 필요한 모든 절차와 규제를 관할하고 있음. 세부적인 내용은 2017년 9월 11일에 발표된 Food Safety and Standard Regulation 2017 규칙에 의거함.
ㅇ 제품 등록 절차
- 수입식품은 FSSAI 내의 Vigilance/Import Department에서 담당하고 있음. 실질적인 업무에서는 Standard and Quality Assurance Department 또한 관여하게 됨.
- 의료기기 기준 세부적인 절차는 다음과 같으며, 소요기간은 서류 접수 후 6개월 정도임.1단계
서류 준비: form-1 서류(제품명, 주요 원료, 인도 외부기관의 제품 등록증, 제조과정 설명, 제품과 관련된 제조사·유통사의 보증증빙, 안전사항 설명서, 인도에 최초로 도입되는 원료 혹은 기술에 대한 언급, 상품의 섭취 결과에 대한 리포트)
· http://fssai.gov.in/home/food-standards/Non-Specified-Food---Ingredients-Approval.html
2단계
서류 제출: 상기 서류와 등록 비용의 접수
· 등록비용: 5만 루피
□ 시사점
ㅇ 제품별로 요구되는 인증절차를 면밀히 확인할 필요
- 인도의 제품 인증은 대부분 인도표준국 BIS를 따르고 있으나 전기전자제품, 식품, 의료기기, 방사선 제품에 대해서는 별도의 표준이 있다는 사실을 알아야 함.
- 특히 일부 품목의 경우 2개 이상의 제품 등록이 필요한 경우가 있기 때문에 현지 로펌, 협력 수입상 등을 통해 어떤 종류의 인증이 필요한지 파악해야 함.
ㅇ 복잡한 제도, 제품 등록이 비관세장벽으로 작용함.
- 점차 개선되고 있으나 인도의 제품인증 절차와 제도는 아직 보완이 필요한 상황임. 의약품과 의료기기의 경우, 뚜렷한 관련 법령이 없어 수입업자에게 혼란을 주는 경우가 많았으나 최근 관련 규칙이 제정돼 내년부터 시행될 예정임.
- 사전준비가 미비할 경우 제품의 등록이 정해진 기간보다 오래 걸리는 경우가 부지기수이며, 인도 정부기관의 홈페이지에 안내된 내용 이외에도 타기업의 선례 등을 참고해 실무에 반영할 필요가 있음.작성자: KOTRA 뉴델리 무역관 임성식 과장, Jaya Soin S.Mng.
자료원: 관련 기관 홈페이지(BIS, FSSAI, CDSCO) 공시자료, 현지 관련 수입상 인터뷰, KOTRA 뉴델리 무역관 자료 종합<저작권자 : ⓒ KOTRA & KOTRA 해외시장뉴스>

KOTRA의 저작물인 (인도 진출의 관문, 제품 인증에 대해)의 경우 ‘공공누리 제4 유형: 출처표시+상업적 이용금지+변경금지’ 조건에 따라 이용할 수 있습니다. 다만, 사진, 이미지의 경우 제3자에게 저작권이 있으므로 사용할 수 없습니다.
-
1
2022년, 더욱 중요해지는 인도 BIS 인증제도
인도 2022-01-28
-
2
인도 진출 시 확인해야 할 주요 인증제도 및 품목
인도 2020-10-27
-
3
인도 BIS 신규 인증 발효, 우리 기업이 주의할 점은?
인도 2021-04-26
-
4
FSSAI 인증 및 등록 절차
인도 2020-05-22
-
5
[전문가 기고] 에콰도르 상표등록 요건 및 절차
에콰도르 2018-10-05
-
6
[유망] 에콰도르 화장품 시장동향
에콰도르 2017-12-13
-
1
2023년 인도 전기자동차 산업 정보와 현지 동향
인도 2023-12-12
-
2
2022년 인도 반도체산업 정보
인도 2022-10-20
-
3
2022 인도 완구산업 정보
인도 2022-08-05
-
4
2022년 인도 화장품 산업 정보
인도 2022-05-25
-
5
2021년 인도 철강산업 정보
인도 2022-01-20
-
6
2021년 인도 보안산업 정보
인도 2022-01-20













