-
이집트 의료기기 등록 규정 및 절차 안내
- 트렌드
- 이집트
- 카이로무역관 김지혜
- 2016-12-07
- 출처 : KOTRA
-
Keyword #이집트 의료기기 등록 규정 #이집트 의료기기 등록 절차
- 통상은 에이전트가 진행, 등록 실패도 있어 맹신은 금물 -
- 능력과 경험이 풍부한 에이전트 선정이 필수, 등록에는 통상 1년 이상 소요 -
□ 이집트 의료기기 등록 관련 문제점
ㅇ 이집트의 의료기기 시장은 연간 6억 달러 규모가 넘는 유망시장이나 이집트는 의료기기 등록 절차가 까다로운 것으로 정평이 나 있어 시장 진입장벽이 높음.
ㅇ 통상적으로 의료기기 등록은 수출기업이 준비한 서류를 받아 에이전트가 현지에서 진행을 하나, 의료기기 등록 실패로 인해 제품 통관 불가, shipback, 클레임 발생 등의 문제가 발생하는 경우가 종종 있어 주의가 요망됨.
□ 이집트 의료기기 등록 관련 제도
ㅇ 이집트에서 의료기기의 등록 관련 업무는 이집트 보건부 산하의 CAPA(Central Administration for Pharmaceutical Affairs)가 담당
ㅇ 이집트는 참조국(Reference Countries) 제도를 운영 중으로, 참조국에서 제조된 의료기기의 경우 수출이 용이한 반면 참조국 이외 국가는 의료기기 등록 절차가 상대적으로 어려움.
- 해외 참조국가(Reference Countries)는 호주, 오스트리아, 벨기에, 캐나다, 덴마크, 핀란드, 프랑스, 독일, 아이슬란드, 이탈리아, 일본, 룩셈부르크, 네덜란드, 뉴질랜드, 노르웨이, 스페인, 스웨덴, 스위스, 영국, 미국, 포르투칼, 아일랜드 등 22개국임.
ㅇ 이집트는 유럽의 위해성 분류체계(Directive 93/42/EEC)를 도입해 각각의 의료기기를 ClassⅠ(위해성이 낮은 단계), ClassⅡa/ClassⅡb(중간단계), ClassⅢ(높은 단계)로 분류하고 있으며, 위해성에 따라 등록을 위해 필요한 절차를 달리 적용
- ClassⅠ분류를 제외한 모든 의료기기는 참조국 중 하나에서 발행된 자유판매증명서(Free Sales Certificate) 및 품질인증(CE 혹은 FDA)이 필요함.
- ClassⅢ에 속한 의료기기의 경우 반드시 기술문서(Technical File) 원본을 추가로 제출해야 함.
□ 등록 절차
ㅇ CAPA 내 의료기기 등록을 위한 일반 절차는 아래와 같음.
의료기기 등록 및 인허가 절차
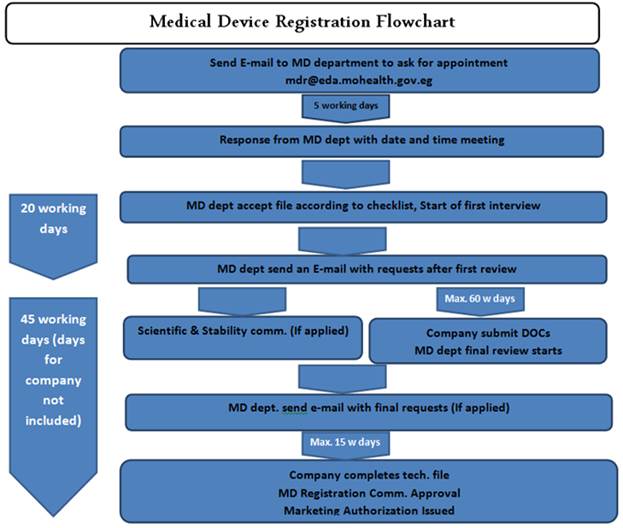
자료원: Central Administration for Pharmaceutical Affairs(CAPA)
□ 등록 서류
ㅇ 의료기기 등록에 필요한 서류는 아래와 같음.
① 등록요청서 작성
- 등록요청서에는 의료기기명, 제조업체명 그리고 원산지를 포함한 이집트 수입기업의 서명 혹은 도장이 찍혀야 함.

② 일련번호가 매겨진 등록파일 목차, 의료기기 등록비 3500EGP 지불 영수증
- 파일에는 브랜드명, GMDN 또는 UMDN 코드, ‘European Directive of the Medical Devices 93/42/EEC’에 따른 상품 분류, 용도, 제조자 그리고 의료기기의 원자재가 포함돼야 함.
③ 이집트 업체의 수입 허가증(원본 + 복사본), 에이전시의 경우 C14서식과 상업등기부(원본 + 복사본)
④ ISO 13485 인증서
⑤ CE 혹은 FDA가 발급한 CFA 인증서
⑥ 참조국(Reference Country)의 경우, 해당 국가 보건부에서 발행한 자유판매증명서(Free Sale Certificate), 참조국이 아닌 경우 이집트가 운영 중인 참조국에서 발행한 자유판매증명서 제출 필요. 이 증명서에는 상표, 의료기기 코드, 공장명이 포함돼야 함.
⑦ 제조업체로부터 발급돼 서명 및 사인된 ‘Declaration of Conformity Certificate’
- 브랜드명과 상품명, European Directive of the Medical Devices 93/42/EEC’에 따른 분류, CE 인증서 번호, 상품코드, 용도, 규격, 조립 세트의 내용물 내역(세트의 경우), 연락처 기재
⑧ 기술사양(Technical File, 서명 및 날인된 제조공장 레터헤드지에 작성)
a. 원자재 부품 증명서(Raw material composition certificate)
b. 분석 증명서(생물학, 화학, 물리학): 지원 방식을 제조 기준에 따랐으며, 제조업체에 의한 책임(모든 제조업체 기준이 언급돼 있어야 함)을 확증하는 분석 설명서
c. 멸균증명(Sterilization certificate)
d. 포장재료 증명서와 구성단위의 수
e. 생산된 제품의 내/외부 라벨
f. 생산된 제품의 규모와 스케치된 도표
g. 제품, 부품, 내부 전단을 설명하는 카탈로그
h. 사용설명서(IFU, Instructions for Use) 원본
i. 전자 라벨링의 경우 인증된 IFU는 해외 공장으로부터 제공받아야 하며, 수입하는 기업은 수입하는 각각의 제품에 IFU를 부착할 것이라는 보증을 해야 함.
j. 의료기기의 보관조건과 기기 상표가 명시된 유통기한 인증서
k. 등록을 원하는 의료기기의 샘플
* 위에서 안내된 절차 및 서류는 일반적으로 의료 기기를 등록하기 위한 예시로, 구체적 절차 및 실제 서류는 의료기기 종류에 따라 (치과용 의료기, 엑스레이 등) 상이할 수 있음을 유의
□ 시사점
ㅇ 등록 서류가 현지어로만 돼 있는 경우가 많고, 등록 정보가 부족해 통상은 바이어(에이전트)를 통해 의료기기 등록 절차를 진행을 할 수밖에 없음. 에이전트는 계약조건에 따라 등록 부대 비용 납부, 서류 제출, 샘플 보관 등의 각종 현지 업무를 지원하게 됨.
ㅇ 의료기기 등록은 통상 1년 이상 걸리기 때문에 인내심을 갖고 임해야 하며, 에이전트 역시 의료기기 등록에 많은 노력과 지식이 필요하므로 해당 분야에 경험과 능력이 풍부한 에이전트를 선정하는 것이 중요
ㅇ 우리나라의 의료기기 수출 희망 중소기업 중에는 참조국 내 FSC가 없어 이집트로의 수출을 단념해야 하는 경우도 많아 시장 진입장벽이 높은 관계로, KOTRA 카이로 무역관에서는 우리나라를 의료기기 참조국에 포함해줄 것을 이집트 보건부에 요청하고 있음. 이러한 노력이 결실을 맺게 될 경우에 미리 대비해 시장 개척 노력 필요
자료원: KOTRA 카이로 무역관
<저작권자 : ⓒ KOTRA & KOTRA 해외시장뉴스>

KOTRA의 저작물인 (이집트 의료기기 등록 규정 및 절차 안내)의 경우 ‘공공누리 제4 유형: 출처표시+상업적 이용금지+변경금지’ 조건에 따라 이용할 수 있습니다. 다만, 사진, 이미지의 경우 제3자에게 저작권이 있으므로 사용할 수 없습니다.
-
1
중국 영유아 이유식 시장 현황
중국 2016-12-07
-
2
오스트리아, 자율주행차 도로시험 주행 허용으로 관련 시장 성장 기대
오스트리아 2016-12-07
-
3
현지화·다양화되는 러시아 포장재 시장
러시아연방 2016-12-07
-
4
중국 전자담배 시장 현황 및 전망
중국 2016-12-07
-
5
日, 확대되고 있는 100엔숍 경제권
일본 2016-12-06
-
6
호주에서 가성비 좋은 기능성 치약 인기
호주 2016-12-06
-
1
2021 이집트 ICT 산업 정보
이집트 2022-01-21
-
2
2021년 이집트 자동차산업 정보
이집트 2022-01-20
-
3
이집트 프로젝트 산업 현황
이집트 2022-01-19
-
4
2021 이집트 철강산업 정보
이집트 2022-01-19
-
5
2021 이집트 관광산업 정보
이집트 2022-01-10
-
6
이집트의 산업 개관
이집트 2022-01-06
- 이전글
- 다음글













